2. 同济大学附属第十人民医院检验科,上海 200072
2. Department of Laboratory Medicine, Tenth People's Hospital, Tongji University, Shanghai 200072, China
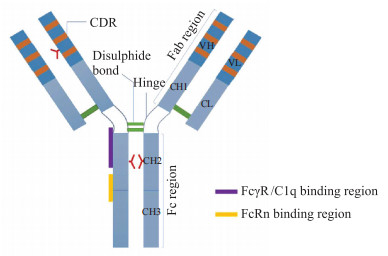
抗体是人体在抵御外来病原体时分泌的物质,有特殊的靶向亲和力。抗体是一类能与抗原特异性结合的免疫球蛋白(immunoglobulin,Ig),由B淋巴细胞产生,可应用于癌症、自身免疫性疾病、炎症、感染等多种疾病的治疗。抗体在临床中可以分为很多类别,目前临床主要研发与使用的抗体形式是IgG1亚型[1]。抗体的单体是一个Y形分子,由4条多肽链组成,包括2条相同的重链和2条相同的轻链,2条重链之间以及重链和轻链之间都是由二硫键连接。重链在IgG亚类之间的序列同源性超过90%,但恒定区结构域表面暴露残基之间存在差异,铰链区内也存在实质性差异,正是这种铰链结构赋予了每个IgG亚类许多独特的性质,如稳定性、灵活性等[2]。在蛋白水解酶如木瓜蛋白酶的作用下,IgG分子可以被裂解为2个完全相同的抗原结合片段(fragment of antigen binding,Fab段)及1个可结晶段(fragment crystallizable,Fc段)。Fc段与Fab段通过铰链区连接。Fab段也叫抗原结合片段,是抗体结构中可以与抗原结合的区域,由1条完整的轻链和重链的VH和CH1结构域组成(图 1)。抗体的尾部则为Fc段,是一种同源二聚体蛋白,每条链由2个结构域(CH2和CH3)和一个位于297位的N连接糖基化组成。Fc段第297位Asn上有2个保守的N-糖基化位点,它们共价连接在CH2结构域中的保守Asn297位点上,2条链通过铰链区中的2个二硫键共价连接,并且通过2个CH3结构域之间的广泛相互作用非共价连接[3-4]。
|
| 图 1 抗体结构示意图 Fig 1 Antibody structure diagram CDR: complementarity determining region; FcRn: neonatal Fc receptor; FcγR: Fcγ receptor. |
Fc段包含了所有抗体分子共有的蛋白质序列以及各个类别独有的决定簇,有多种生物学活性[5-6]。Fc段通过与新生儿Fc受体(FcRn)结合可以影响抗体的血清半衰期,通过与Fcγ受体(FcγR)或C1q补体蛋白结合可发挥效应子功能[2]。且抗体在仅有Fc段的情况下,也可以发挥一定的作用,比如IgG的Fc结构域可以单独介导单纯疱疹病毒感染细胞的识别和清除[7]。Shields等[8]还通过丙氨酸扫描诱变的方法确定了Fc结构域受体的结合部位以及关键的氨基酸位点,FcγR和C1q的结合位点位于低铰链区和CH2近端区域,FcRn的结合位点位于CH2与CH3的交界处(图 1),这为优化Fc与Fc受体的结合奠定了基础。IgG作为靶细胞或病原体与免疫细胞之间的适配器,通过其可变区与抗原结合,并通过其保守的Fc区与免疫细胞上的FcγR相互作用,从而激活免疫应答达到治疗效果。
近年来,IgG类抗体被广泛地开发应用。Fc区作为IgG分子上的一段固有结构,可以与Protein A结合,便于后续的抗体纯化。此外,对Fc区的糖链或蛋白序列进行改造,可以显著延长半衰期,增强或抑制抗体依赖性细胞介导的细胞毒性(antibody-dependent cell-mediated cytotoxicity,ADCC)、抗体依赖性细胞介导的吞噬作用(antibody-dependent cellular phagocytosis,ADCP)、补体依赖性细胞毒性(complement dependent cytotoxicity,CDC)等效应。因此,开发新型的Fc突变体是一种新型的研发策略,也是目前抗体工程主要工作之一。
1 抗体药物作用机制抗体药物的独特优势是体内特异性结合,因其作用机制不同,可分为以下几种类型。(1)通过ADCC、ADCP、CDC效应杀死异常细胞的细胞毒性药物;(2)通过调节细胞激活和细胞间相互作用来发挥作用的药物,包括通过阻止T细胞激活来用于自身免疫性疾病和器官移植后排斥反应的治疗性药物、用于癌症治疗的激活免疫系统类药物以及通过阻止细胞间发生相互作用来阻断一些损伤性反应发生的药物;(3)通过抑制细胞生长和增殖的用于治疗癌症的药物;(4)通过调节人自身的免疫系统来治疗自身免疫性疾病的药物;(5)通过中和外源分子发挥保护机体作用的药物等。
抗体的Fab段可以与侵入机体的免疫原性物质特异性结合,Fc段可以非特异性地结合白细胞、巨噬细胞以及血清补体C1q等,从而引发ADCC、ADCP、CDC等[5]。ADCC是Fc段与自然杀伤(NK)细胞等结合后,通过分泌穿孔素、颗粒酶等细胞毒物质杀伤靶细胞,引起细胞凋亡实现清除靶细胞的目的;ADCP是通过Fc段与吞噬细胞结合后,发生吞噬作用从而清除靶细胞;CDC则是通过补体蛋白在细胞表面形成膜攻击复合物后,攻击靶细胞引起靶细胞凋亡,从而清除靶细胞。基于这些相关的毒性作用在部分疾病的治疗中需要被强化,而在一些疾病的治疗中则需要被抑制,因此,对Fc段进行改造,在疾病治疗中获得所需要的效应子功能,实现药物疗效的最大化。通过一些技术手段赋予Fc段与抗原结合的能力,使Fc段具备完整的抗体功能,实现更小抗体分子的突破,获得更好的药物疗效。因此,对Fc段的改造可使抗体药物“因病而异”,更好地发挥抗体药物的优势。
IgG分子的优势在于其对靶抗原有高亲和力以及在血液中有较长的半衰期。与其他亚型的IgG分子相比,IgG1和IgG3的ADCC作用和CDC作用要强得多。但是IgG3的半衰期较短,并不是抗体药物偶联物的理想选择。因此,目前大多数ADC药物都是采用IgG1支架构建。此外,其他抗体亚型的缺陷也可以通过对Fc段改造得到改善。例如天然的IgG4分子有与其他抗体交换Fab臂的倾向,这种倾向使其很难在临床应用。在IgG4的铰链区加入单一的S228P突变可以有效避免Fab臂交换,提高IgG4衍生的治疗性抗体的可制造性[9]。未来的抗体药物也将根据每种临床适应证的独特要求而设计,以达到其预期的治疗目的[10]。
2 Fc结构域功能改造策略抗体可作为激动剂、拮抗剂或诱导剂等药剂使用[11]。ADCC/ADCP对治疗性抗体发挥体内药效有重要意义,选择性地增强这些细胞毒性效应是增强治疗性抗体药物疗效的重要方式之一,在抗肿瘤类的抗体药物中可显著增强对肿瘤细胞的杀伤力,提升药物的抗肿瘤活性;在清除病原体类的药物中,可以提高对病原体的清除能力,实现更好的免疫效果[12-14]。目前关于Fc结构域改造的主要方向集中于增强Fc与激活型FcγR之间的亲和力,放大其介导的细胞效应,从而增强对癌症的治疗效果。但是,对于阻断受体或细胞因子型抗体,其伴随的细胞效应会是多余甚至有害的。因此,在这类抗体药物的研发过程中,需要去除Fc段所介导的功能。
此外,FcRn所介导的半衰期延长改造也是目前Fc结构域改造的研究重点。Fc结构域功能改造应用最广泛的方法是氨基酸替换策略。FcγR在许多生物学过程(感染、肿瘤、免疫疾病)中发挥着重要作用[15]。FcγR有正负调节功能,为免疫细胞的激活建立了一个阈值[15]。已知人类免疫细胞可以表达6种免疫球蛋白结合的FcγR(FcγRⅠ、FcγRⅡa、FcγRⅡb、FcγRⅡc、FcγRⅢa、FcγRⅢb)[16],分别起激活和抑制作用。大多数髓系细胞都可以在其表面同时表达激活型和抑制型FcγR,因此,抗体可以与同一细胞上激活型和抑制型FcγR结合[15]。激活和抑制信号之间的平衡是免疫系统用来调节免疫反应的重要机制。在不同的疾病治疗中,对抗体Fc段介导的效应子功能的需求是不同的。例如,在癌症免疫治疗中,抗体的设计目的是触发激活型受体所介导的反应,激活FcγR与抑制FcγR结合的比值是决定抗肿瘤单抗的重要因素[17];而在治疗IgG介导的自身免疫性疾病时,则需要抑制过敏反应,放大FcγRⅡb的抑制信号[10]。
基于FcγR之间介导的不同的效应子功能以及对不同疾病的治疗需求,对抗体的Fc段结构域进行优化,Fc段改造的设计不仅是为了增强细胞毒性,而是通过适当的FcγR参与来增强T细胞记忆反应[18],可实现更优的治疗效果。
2.1 FcRn介导的抗体半衰期延长改造IgG的Fc段与FcRn的结合被证明会影响抗体的半衰期,且FcRn功能不仅限于IgG转胞吞作用,而且还参与IgG和白蛋白的再循环过程[19]。IgG与FcRn的结合有很强的pH依赖性,溶酶体内的酸性(pH 6.0~6.5)环境会促进IgG-FcRn的结合,两者有较高的亲和力,可以从溶酶体的降解中释放出来,循环到细胞表面。而在细胞外的生理条件(pH 7.4)下,IgG-FcRn会发生解离,从而释放IgG,维持抗体分子的长循环,延长抗体半衰期[20]。
在Fc与FcRn发生结合及解离的过程中,组氨酸残基(H310、H435、H436)表面的电荷会发生变化,这一过程似乎起到了重要的pH传感器的作用[2, 17]。这些氨基酸在pH≤6.5时带正电,从而导致与酸性FcRn残基(FcH310/FcRn E117、FcH435/FcRn E132、FcH436/FcRn D137)形成盐桥;在pH≥7时,组氨酸残基去质子化,FcRn从结合的Fc中释放出来[21]。这种循环机制主要发生在血管内皮细胞、肾脏和血脑屏障中,目前主要被用来延长抗体药物的半衰期[19]。
不仅如此,IgG与FcRn的结合也有潜在的治疗价值。如“清除”抗体(“sweeping”antibodies)可依靠FcRn介导的循环机制发挥清除病原体的作用,在细胞表面“sweeping”抗体可以与FcRn和抗原结合,被内吞进入溶酶体后释放抗原,抗原在溶酶体的酸性环境中被清理,循环到细胞表面时“sweeping”抗体仍然与FcRn以复合物状态存在。“sweeping”抗体与传统的抗体相比,在清除抗原方面似乎效果更好,且在给药频率和剂量方面可能更具有优势[22-23]。
目前已有研究[24]通过使用高通量诱变的方法广泛开展Fc改造工程以增强与FcRn的结合亲和力,以延长抗体循环半衰期。Fc工程突变体最常见的突变包括氨基酸残基250和428上的QL突变,单个氨基酸上的N434突变,氨基酸残基428和434上的LS突变,以及氨基酸残基252、254和256上的YTE突变等。在研究[25-28]中已被证明,与野生型相比,Fc工程突变体与FcRn的结合有了显著的提高,且体内血清抗体保留时间增加了2~4倍。
有3个突变点(M252Y、S254T、T256E)的YTE突变体是首个用于延长抗体半衰期的Fc改造体,通过增强与FcRn的结合,从而使抗体半衰期延长,例如Motavizumab-YTE(Mota-YTE)[29],其与FcRn的结合能力提高了10倍,在猴子体内的血浆半衰期延长了4倍。用于延长半衰期的突变体在酸性pH下与FcRn的结合亲和力大幅提高,且在中性pH下能与FcRn很好地解离。包含2个突变的Fc变体(T250Q/M428L),在pH 6.0时与人FcRn结合增加了28倍,在恒河猴体内实现了半衰期延长约2.5倍[30]。包含单一突变的Fc变体(N434A)也大幅提高了在酸性pH下与FcRn的结合亲和力,使食蟹猴血清抗体半衰期延长了2.3倍[31](表 1)。Xencor公司还筛选分离得到了一个Fc变体(M428L/N434S),其在pH 6.0时对FcRn的亲和力提高了约10倍,其在血清中半衰期延长了3.1倍[25, 32]。
IgG-FcRn之间的这种基于pH的半衰期调控机制,可以在控制治疗中改善IgG单克隆抗体的药代动力学,IgG单克隆抗体Fc区的定点诱变已成为调节抗体半衰期的首选策略[28]。
2.2 糖基化改造抗体作为一种免疫球蛋白,其本质都是糖蛋白,在Fc结构域至少携带1个或多个保守的N-连接寡糖(N-多糖)。IgG上的FcγR结合区包括部分CH2和铰链区,Fc结构域与FcγR的结合会受到N297位糖基化的影响[1-2]。因此,可以通过对Fc片段进行糖基化改造,利用基因工程等方法改善抗体所介导的效应器功能。
因与Fc相连的核心岩藻糖对碳水化合物介导的Fc与FcγRⅢa的相互作用造成了直接的空间抑制,在抗体分子的糖基化改造中,去除N-连接聚糖中的岩藻糖可以增强Fc与FcγRⅢa的结合亲和力,并增强ADCC活性[33-34]。去除N-连接聚糖中的岩藻糖的方法有,敲除岩藻糖基转移酶基因以及过量表达β-1, 4-N-乙酰氨基葡糖糖氨基转移酶。
已有研究[35]对糖基化FcγRⅢa和人岩藻糖基化或非岩藻糖基化Fc之间复杂的晶体结构进行了分析,揭示了Fc和FcγRⅢa的碳水化合物之间通过独特的相互作用来调节亲和力,进而调节其所介导的效应器功能,该研究[35]还指出Fc-聚糖上的核心岩藻糖就是调节这种结合的关键元素。
目前已经改造成功的糖基化抗体药物有Mogamulizumab——使用岩藻糖基转移酶8(FUT8)敲除细胞系生产得到的非岩藻糖基化抗CD20抗体。与非糖基化改造抗体相比,Mogamulizumab的ADCC活性提高了100倍[36-38],主要用于治疗复发及难治性成人干细胞白血病、淋巴瘤[39]。此外,缺乏Fc相关核心岩藻糖的Ⅱ型抗CD20抗体Obinutuzumab,在临床上与苯丁酸氮芥联合用于治疗慢性淋巴细胞白血病和非霍奇金淋巴瘤[40-42]。由于大鼠骨髓瘤细胞YB2/0的FUT8基因表达水平较低,因此它产生的核心岩藻糖含量低,也成为了一种新型的表达非岩藻糖基化抗体的表达体系[43]。
除Fc-聚糖上的核心岩藻糖之外,Fc结构域上的半乳糖基化也被证明与自身免疫性疾病相关,其糖基化水平的降低会引发系统性红斑狼疮和类风湿性关节炎等[44-45]。通过对Fc结构域进行糖基化改造进而调节免疫受体介导的效应器功能是合理设计治疗性抗体Fc变体的有价值的技术路线[35]。
2.3 蛋白质工程改造目前,氨基酸序列优化技术已被用于提高FcγR结合亲和力和特异性,从而改善效应器功能,通过结合基于结构的计算机辅助蛋白质设计方法与高通量蛋白质筛选,优化抗体Fc结构域与FcγR结合能力,增强细胞毒性作用[46]。
一些有优化Fc结构域的突变体改善了与FcγR的结合,可产生对激活型受体亲和力显著增加的抗体,从而增强了效应子所介导的杀伤和凋亡活性[47]。含有双突变Fc (S239D/I332E) 的抗CD19抗体以及抗CD40的抗体,显著增强了抗体对B细胞淋巴瘤和白血病细胞的细胞毒性。此外,Xencor通过计算机筛选分离得到含有三突变Fc (S239D/I332E/A330L) 的抗CD96抗体。以上2种突变体均显示出对FcγRⅢa选择性的高结合能力,ADCC活性增强100倍以上,对一些反应较弱的患者群体可以实现较高的临床疗效,显著提高了体内肿瘤细胞的清除率[13, 46-47]。Fc突变体(G236A)也可以选择性地激活FcγRⅡa,而不影响FcγRⅡb的抑制作用,相对于FcγRⅡb,它与FcγRⅡa的选择性增强结合;Fc突变体(G236A)与FcγRⅡa的亲和力提高了70倍,FcγRⅡa/FcγRⅡb的激活抑制比也提高了15倍,从而增强了巨噬细胞介导的ADCP,且该突变体与S239D/I332E联合应用时,可以同时增强巨噬细胞介导的ADCP以及NK细胞介导的ADCC[48]。
酵母表面展示技术筛选Fc突变体库,可得到有所需FcγR结合特异性的Fc结构域。利用该方法分离得到的Fc变体(F243L/R292P/Y300L/V305I/P396L)可选择性地提高与免疫细胞上表达的激活型FcγR的结合,对恶性肿瘤细胞的清除率提高了100倍以上,并提高了肿瘤异种移植小鼠模型存活率[49]。
还有研究[14]指出,采用不对称的方法对抗体分子的2条Fc链进行不同的优化突变,可以更好地区分激活受体与抑制受体的亲和力,增加Fc变体的激活抑制比(与FcγRⅢa或FcγRⅡa结合增加但与FcγRⅡb结合减少或保持不变),显著增强体内活性,从而获得更好的抗肿瘤疗效。引入2个电荷残基对(K392D:K409D和E356K:D399K)制备得到的Fc异二聚体突变对激活型FcγRⅡa的选择性明显高于抑制性FcγRⅡb。Fc异二聚体变体(K392D/K409D/S239D/A330F/K334V:E356K/D399K/L234Y/K290Y/Y296W)与Fc同源二聚体变体(S239D/I332E或S239D/A330L/I332E)相比,FcγRⅢa的结合亲和力有了较大的提高,有更强的ADCC活性和抗肿瘤作用[14, 46]。
2.3.1 C1q介导的补体细胞毒性改造募集补体从而介导细胞杀伤功能是激动剂类或募集免疫细胞类抗体药物发挥药效的重要途径之一[50]。IgG抗体与细胞表面的抗原结合后可以通过相邻IgG分子的Fc片段之间的特定非共价相互作用组装形成六聚体结构,六聚体结构是IgG与C1q紧密结合以及激活补体的基础[51]。抗体Fc区与C1q结合后,会启动补体级联蛋白的组装,进而形成膜攻击复合物并清除靶细胞。IgG铰链区和CH2结构域是影响C1q结合从而影响补体激活反应的重要因素[51]。因此,通过对CH2结构域中的C1q结合位点或铰链区的重要位点进行定点突变,可提高或降低其与C1q的结合亲和力,进而增强或减弱CDC效应[52]。此外,补体的激活不仅有直接介导细胞毒性的作用,还可以吸引和激活效应细胞诱导杀伤肿瘤细胞,在抗肿瘤的治疗中起到了协同作用[51]。
位于CH2结构域中C1q结合域末端的残基K326和E333在控制IgG分子的生物活性中起重要作用,当K326和E333两个位点单独或组合突变时,均会导致C1q结合和CDC活性的显著增加[53]。包含单一突变的K326W突变体与C1q的结合增强了3倍、CDC活性增强了2倍;E333位点可以被多种氨基酸取代从而增加与C1q结合以及增加CDC活性,其中E333S突变体可介导最高的C1q结合水平和CDC活性的提高,使C1q结合最高增强了2倍、CDC活性最高增加了1.6倍;有2个突变点(K326W/E333S)的利妥昔单抗突变体与C1q的结合亲和力提高了5倍,并伴随着2.3倍增强的CDC效应[50, 54]。此外,包含S267E、H268F和S324T的抗CD20突变体也显示出了较强的增强CDC效果,该Fc突变体将C1q的结合亲和力提高了47倍,从而导致C1q介导的CDC活性提高了6.9倍[55]。此外,嵌合抗体在补体激活效应中也显示出了独特优势,例如IgG1/IgG3嵌合抗体相较于单一抗体而言,展现出了更强的C1q结合能力和更高的CDC效应[56]。
但是,C1q与IgG的结合增强后,不仅增强其与目标抗体的结合,还可能会出现一些非特异性效应,或与一些较小的免疫复合物结合,从而导致次优级补体刺激[57]。因此,在开发抗体药物时,要对可能出现的非目的效应进行综合的考量,以设计出最符合预期的抗体分子。
2.3.2 去除Fc结构域功能改造拮抗剂等类别的抗体药物的靶点多位于细胞上且以免疫细胞居多,在药物发挥作用时可能会触发相应的细胞效应,在这类药物中细胞效应可能是有害的,因此须去除Fc结构域的功能[58]。例如败血症、移植排斥等系统补体级联反应过度激活的情况、炎症性疾病、系统性红斑狼疮等自身免疫性疾病长期激活并损害健康组织的情况,抑制CDC效应减少补体相关的炎症反应可能对患者更有益[51]。已知改造方法有,IgG1变体L234A/L235A[59]、IgG2变体H268Q/V309L/A330S/P331S[60]、IgG4变体L235E或F234A/L235A等都可有效降低抗体Fc结构域与C1q的结合,抑制CDC效应,减少细胞因子等的释放[58]。非糖基化突变(N297A、N297Q和N297G)不能与FcγR很好地结合,可能也是去除Fc策略之一[61]。此外,竞争抗原结合位点以及分子间的立体干扰可能会干扰Fc-Fc接触的形成,从而抑制六聚化、C1q结合和补体激活[62]。
2.3.3 FcγRⅡb介导的负反馈调节在自身免疫性疾病以及异体移植免疫排斥等方面,抑制性受体FcγRⅡb通过抑制免疫细胞活化在此类疾病的治疗中发挥了重要的负反馈作用。抗CD19的Fc突变体(S267E/L328F)直接通过B细胞受体和抑制性FcγRⅡb共同作用,不依赖于通过抗体与激活的Fc受体相互作用来募集效应细胞,与FcγRⅡb结合亲和力增加了430倍,从而抑制了人B细胞的增殖[63-64](表 2)。但是,由于FcγRⅡb和FcγRⅡa-R131在结构上有相似性,因此在提高FcγRⅡb的结合亲和力的同时,也会在一定程度上增强与FcγRⅡa-R131亚型的结合亲和力。为了改善与FcγRⅡb的选择性结合,Mimoto等[63]对Fc突变体(S267E/L328F)进行了进一步的优化,通过引入P238D突变,改变了CH2结构域的构象,使FcγRⅡb的结合亲和力提高了200多倍,而不增加与任一FcγRⅡa同种异型的结合。这种选择性增强FcγRⅡb结合的Fc变体,在自身免疫性疾病中有潜在的治疗价值。
| Fc variants | Function |
| S239D/I332E/A330L or S239D/I332E | Enhanced binding to FcγRⅢa compared to FcγRⅡb[13, 46-47] |
| F243L/R292P/Y300L/V305I/P396L | Enhanced binding to FcγRⅢa compared to FcγRⅡb[49] |
| K392D/K409D/S239D/A330F/K334V; | |
| E356K/D399K/L234Y/K290Y/Y296W | Enhanced binding to FcγRⅢa[14] |
| G236A | Enhanced binding to FcγRⅡa[48] |
| S267E/L328F/P238D | Enhanced binding to FcγRⅡb compared to FcγRⅡa[63-64] |
| S267E/H268F/S324T | Enhanced binding to C1q[55] |
| K326W or E333S or K326W/E333S | Enhanced binding to C1q[50, 54] |
| L234A/L235A | Reduced binding to FcγR and C1q[59] |
| H268Q/V309L/A330S/P331S | Reduced binding to FcγR and C1q[60] |
| L235E or F234A/L235A | Reduced binding to FcγR and C1q[58] |
Fc片段的可塑性使其能作为支架并保留所有抗体特性,同时Fc片段本身是一种非常稳定的蛋白质,且通过引入稳定的域内二硫键来增加Fc结构域中CH3域的内在稳定性,这也使得其可以很好地适应环区中的突变,稳定化CH3结构域为Fc片段的工程设计提供了一个极好的基础支架,可用于抗原结合或其他所需的附加或改进特性[65]。
IgG1的Fc片段是一种理想的替代小分子抗体形式,这种片段的小尺寸提供了潜在改善组织渗透和生产效益的优势。尽管Fc片段有十分重要的功能,但Fc片段并不具备体内结合抗原的特异性,这使得其生物学效应的产生必须依赖于Fab区的抗原结合能力,通过基因融合或者化学连接的方式可以使单独的Fc片段获得结合抗原的能力。通过在C末端的不参与形成效应分子的CH3结构域中设计功能环,可以将抗原结合位点紧密插入[4],而Fc支架的整体结构保持不变,天然配体如FcγRⅠ或FcRn的结合并不会受到影响[66-68]。HER2特异性Fcab(Fcab:有抗原结合位点的Fc结构域)也已被证明可触发ADCC,这表明NK细胞上与FcγRⅢ的相互作用也得以维持[69]。通过改造CH3结构域的C端环,Fc段功能化形成抗原结合位点但并不会影响Fc段本身的功能。研究人员[68]通过流式细胞仪对创建的酵母基因工程Fc片段展示文库进行分类,获得了可以和HER2/neu特异性结合并有高亲和力的Fc片段:Fcab。Fcab支架在1个相对分子质量为50 000同源二聚体蛋白中汇集了普通抗体的所有特征:抗原结合、效应器功能和较长的体内半衰期,这是迄今为止已知的唯一将所有特性结合到一个分子中而无须进一步工程化或衍生化的抗体片段。
3 抗感染中和抗体Fc区改造近年来,抗体药物除了在抗肿瘤方面发挥了重要的治疗作用外,针对病毒等病原体的抗体也成为了用于控制感染的重要治疗剂[70]。与传统的抗肿瘤抗体药物作用机制不同,部分抗体的抗病毒功效需Fab区和Fc区互相协调发挥功能,Fc区通过与免疫细胞上的受体结合,触发相应的细胞效应从而清除病毒并杀死受感染的细胞[71-73]。但是还有一些发挥拮抗作用的抗体,因其作用机制的不同,须抑制Fc区所介导的细胞毒性作用。
在需要Fab区和Fc区互相协调发挥功能的抗感染抗体中,Fc介导的效应子功能是体内关键的抗病毒途径,无法与效应细胞上表达的Fc受体相互作用的突变型Fc结构域变体与体内抗病毒效力的降低有关[74-75]。在抗流感病毒感染的单克隆抗体Fc结构域改造过程中,增强Fc区选择性结合激活型受体FcγRⅡa的结合能力后,抗体分子对小鼠病毒性呼吸道感染的预防或治疗能力会得到明显增强[76]。NK细胞依赖性抗体分子介导的ADCC效应或巨噬细胞与树突状细胞依赖性抗体分子介导的ADCP作用可以通过清除病毒和感染细胞以及通过呈递病毒抗原刺激T细胞反应来参与控制感染[77],这对于开发抗病毒性呼吸道病原体感染的治疗性抗体有重要意义。为提高FcγRⅡa亲和力而设计的单克隆抗体可以提供流感感染的长期预防,尤其是与Fc域突变[例如,LS (M428L/N434S) 变体]结合时,可增加对人FcRn的亲和力并延长体内IgG的半衰期[25]。这表明,对Fc结构域进行工程改造来增加对特定FcγR的亲和力是一种很有效的方法,可以显著提高抗病毒单克隆抗体的临床抗病毒疗效。
不同于抗肿瘤抗体药物,抗感染类抗体药物因药物作用机制的不同对Fc所介导的效应有其独特的需求。在受体拮抗剂以及递送药物的载体等抗体分子中,Fc介导的ADCC作用与抗体分子本身的设计目的不符,可能会导致一些急性炎症不良反应的出现。因此,在这类抗体药物的设计过程中,要去除Fc结构域所介导的毒性作用,LALA(L234A/L235A)突变是目前已知应用最广泛的去除Fc介导的ADCC效应的突变体[59]。在抗SARS-CoV-2感染治疗中,将LALA突变引入CB6抗体后,其在被感染的恒河猴中显示出保护作用,且未出现因ADCC毒性作用引发的急性呼吸损伤、急性呼吸窘迫综合征等不良反应[59]。在异体移植中防治免疫排斥的OKT3药物也采用了LALA突变[78],此外,以LALA突变为基础的LALA-PG(P329G)突变存在较LALA突变更优的去除效应[79],为后期抗体分子的优化提供了新的改造方向。
为延长抗感染抗体半衰期而对Fc区进行改造的方式同本文前述,目前已改造成功的药物有YTE (M252Y / S254T / T256E)突变。其在抗呼吸道合胞病毒的抗体分子Motavizumab[29]以及Nirsevimab中均有涉及[26, 28]。但YTE突变的存在会减弱Fc介导的ADCC作用,因此,在Fc区设计YTE突变延长半衰期时,需要相应添加增强ADCC作用的改造,或为不需要ADCC作用的抗体分子延长半衰期[80]。
4 总结与展望近年来,抗体药物凭借其独特的结构优势,已在多种类型的疾病中发挥了重要的治疗作用,越来越多的疾病预防及治疗开始采用抗体药物。抗体分子的Fc结构域有很大的改造空间,通过对抗体分子的Fc结构域进行改造,可延长抗体药物的半衰期,调控Fc区所介导的功能,以及赋予Fc片段结合抗原的能力等。Fc结构域作为药物分子的独特支架,尚有很多令人期待的功能等待发掘,在不久的将来,Fc工程抗体也将展现出其高功效、低不良反应发生率的优势,并在疾病的预防和治疗中发挥重要作用。
伦理声明 无。
利益冲突 所有作者声明不存在利益冲突。
作者贡献 刘爽:文章构思、数据分析和文章撰写;孙钰芳:文献的搜集和整理;邱熙然:文章的修订及结论的形成;安毛毛、慎慧:研究方向的指导,文章审稿和修订。
| [1] |
PANDEY J P, LUO Y Q, ELSTON R C, et al. Immunoglobulin allotypes influence IgG antibody responses to hepatitis C virus envelope proteins E1 and E2[J]. Hum Immunol, 2008, 69(3): 158-164.
[DOI]
|
| [2] |
IRANI V, GUY A J, ANDREW D, et al. Molecular properties of human IgG subclasses and their implications for designing therapeutic monoclonal antibodies against infectious diseases[J]. Mol Immunol, 2015, 67(2): 171-182.
[DOI]
|
| [3] |
KUBOTA T, NIWA R, SATOH M, et al. Engineered therapeutic antibodies with improved effector functions[J]. Cancer Sci, 2009, 100(9): 1566-1572.
[DOI]
|
| [4] |
LOBNER E, HUMM A S, MLYNEK G, et al. Two-faced Fcab prevents polymerization with VEGF and reveals thermodynamics and the 2.15Å crystal structure of the complex[J]. MAbs, 2017, 9(7): 1088-1104.
[DOI]
|
| [5] |
PARK H I, YOON H W, JUNG S T. The highly evolvable antibody Fc domain[J]. Trends Biotechnol, 2016, 34(11): 895-908.
[DOI]
|
| [6] |
FERNÁNDEZ-QUINTERO M L, GEORGES G, VARGA J M, et al. Ensembles in solution as a new paradigm for antibody structure prediction and design[J]. MAbs, 2021, 13(1): 1923122.
[DOI]
|
| [7] |
DAI H S, GRIFFIN N, BOLYARD C, et al. The Fc domain of immunoglobulin is sufficient to bridge NK cells with virally infected cells[J]. Immunity, 2017, 47(1): 159-170.e10.
[DOI]
|
| [8] |
SHIELDS R L, NAMENUK A K, HONG K, et al. High resolution mapping of the binding site on human IgG1 for Fc gamma RⅠ, Fc gamma RⅡ, Fc gamma RⅢ, and FcRn and design of IgG1 variants with improved binding to the Fc gamma R[J]. J Biol Chem, 2001, 276(9): 6591-6604.
[DOI]
|
| [9] |
VAN DER NEUT KOLFSCHOTEN M, SCHUURMAN J, LOSEN M, et al. Anti-inflammatory activity of human IgG4 antibodies by dynamic Fab arm exchange[J]. Science, 2007, 317(5844): 1554-1557.
[DOI]
|
| [10] |
SONDERMANN P, SZYMKOWSKI D E. Harnessing Fc receptor biology in the design of therapeutic antibodies[J]. Curr Opin Immunol, 2016, 40: 78-87.
[DOI]
|
| [11] |
BREZSKI R J, GEORGIOU G. Immunoglobulin isotype knowledge and application to Fc engineering[J]. Curr Opin Immunol, 2016, 40: 62-69.
[DOI]
|
| [12] |
MOHSENI NODEHI S, REPP R, KELLNER C, et al. Enhanced ADCC activity of affinity maturated and Fc-engineered mini-antibodies directed against the AML stem cell antigen CD96[J]. PLoS One, 2012, 7(8): e42426.
[DOI]
|
| [13] |
HORTON H M, BERNETT M J, PEIPP M, et al. Fc-engineered anti-CD40 antibody enhances multiple effector functions and exhibits potent in vitro and in vivo antitumor activity against hematologic malignancies[J]. Blood, 2010, 116(16): 3004-3012.
[DOI]
|
| [14] |
LIU Z, GUNASEKARAN K, WANG W, et al. Asymmetrical Fc engineering greatly enhances antibody-dependent cellular cytotoxicity (ADCC) effector function and stability of the modified antibodies[J]. J Biol Chem, 2014, 289(6): 3571-3590.
[DOI]
|
| [15] |
MASUDA A, YOSHIDA M, SHIOMI H, et al. Role of Fc receptors as a therapeutic target[J]. Inflamm Allergy Drug Targets, 2009, 8(1): 80-86.
[DOI]
|
| [16] |
JUNG S T, REDDY S T, KANG T H, et al. Aglycosylated IgG variants expressed in bacteria that selectively bind FcgammaRⅠ potentiate tumor cell killing by monocyte-dendritic cells[J]. Proc Natl Acad Sci USA, 2010, 107(2): 604-609.
[DOI]
|
| [17] |
FONSECA M H G, FURTADO G P, BEZERRA M R L, et al. Boosting half-life and effector functions of therapeutic antibodies by Fc-engineering: an interaction-function review[J]. Int J Biol Macromol, 2018, 119: 306-311.
[DOI]
|
| [18] |
BOURNAZOS S, WANG T T, DAHAN R, et al. Signaling by antibodies: recent progress[J]. Annu Rev Immunol, 2017, 35: 285-311.
[DOI]
|
| [19] |
D'HOOGHE L, CHALMERS A D, HEYWOOD S, et al. Cell surface dynamics and cellular distribution of endogenous FcRn[J]. PLoS One, 2017, 12(8): e0182695.
[DOI]
|
| [20] |
MOULD D R, SWEENEY K R. The pharmacokinetics and pharmacodynamics of monoclonal antibodies—mechanistic modeling applied to drug development[J]. Curr Opin Drug Discov Devel, 2007, 10(1): 84-96.
|
| [21] |
MARTIN W L, WEST A P Jr, GAN L, et al. Crystal structure at 2.8 Å of an FcRn/heterodimeric Fc complex: mechanism of pH-dependent binding[J]. Mol Cell, 2001, 7(4): 867-877.
[DOI]
|
| [22] |
IGAWA T, MAEDA A, HARAYA K, et al. Engineered monoclonal antibody with novel antigen-sweeping activity in vivo[J]. PLoS One, 2013, 8(5): e63236.
[DOI]
|
| [23] |
IGAWA T, HARAYA K, HATTORI K. Sweeping antibody as a novel therapeutic antibody modality capable of eliminating soluble antigens from circulation[J]. Immunol Rev, 2016, 270(1): 132-151.
[DOI]
|
| [24] |
MACKNESS B C, JAWORSKI J A, BOUDANOVA E, et al. Antibody Fc engineering for enhanced neonatal Fc receptor binding and prolonged circulation half-life[J]. MAbs, 2019, 11(7): 1276-1288.
[DOI]
|
| [25] |
ZALEVSKY J, CHAMBERLAIN A K, HORTON H M, et al. Enhanced antibody half-life improves in vivo activity[J]. Nat Biotechnol, 2010, 28(2): 157-159.
[DOI]
|
| [26] |
ZHU Q, MCLELLAN J S, KALLEWAARD N L, et al. A highly potent extended half-life antibody as a potential RSV vaccine surrogate for all infants[J]. Sci Transl Med, 2017, 9(388): eaaj1928.
[DOI]
|
| [27] |
DATTA-MANNAN A, WITCHER D R, TANG Y, et al. Monoclonal antibody clearance. Impact of modulating the interaction of IgG with the neonatal Fc receptor[J]. J Biol Chem, 2007, 282(3): 1709-1717.
[DOI]
|
| [28] |
ROBBIE G J, CRISTE R, DALL'ACQUA W F, et al. A novel investigational Fc-modified humanized monoclonal antibody, motavizumab-YTE, has an extended half-life in healthy adults[J]. Antimicrob Agents Chemother, 2013, 57(12): 6147-6153.
[DOI]
|
| [29] |
DALL'ACQUA W F, KIENER P A, WU H. Properties of human IgG1s engineered for enhanced binding to the neonatal Fc receptor (FcRn)[J]. J Biol Chem, 2006, 281(33): 23514-23524.
[DOI]
|
| [30] |
HINTON P R, JOHLFS M G, XIONG J M, et al. Engineered human IgG antibodies with longer serum half-lives in primates[J]. J Biol Chem, 2004, 279(8): 6213-6216.
[DOI]
|
| [31] |
YEUNG Y A, LEABMAN M K, MARVIN J S, et al. Engineering human IgG1 affinity to human neonatal Fc receptor: impact of affinity improvement on pharmacokinetics in primates[J]. J Immunol, 2009, 182(12): 7663-7671.
[DOI]
|
| [32] |
BORROK M J, WU Y, BEYAZ N, et al. pH-dependent binding engineering reveals an FcRn affinity threshold that governs IgG recycling[J]. J Biol Chem, 2015, 290(7): 4282-4290.
[DOI]
|
| [33] |
UMAÑA P, JEAN-MAIRET J, MOUDRY R, et al. Engineered glycoforms of an antineuroblastoma IgG1 with optimized antibody-dependent cellular cytotoxic activity[J]. Nat Biotechnol, 1999, 17(2): 176-180.
[DOI]
|
| [34] |
SHIELDS R L, LAI J, KECK R, et al. Lack of fucose on human IgG1 N-linked oligosaccharide improves binding to human Fcgamma RⅢ and antibody-dependent cellular toxicity[J]. J Biol Chem, 2002, 277(30): 26733-26740.
[DOI]
|
| [35] |
FERRARA C, GRAU S, JÄGER C, et al. Unique carbohydrate-carbohydrate interactions are required for high affinity binding between FcgammaRIII and antibodies lacking core fucose[J]. Proc Natl Acad Sci U S A, 2011, 108(31): 12669-12674.
[DOI]
|
| [36] |
LARTIGUE J D. Mogamulizumab for the treatment of adult T-cell leukemia/lymphoma[J]. Drugs Today, 2012, 48(10): 655-660.
[DOI]
|
| [37] |
YAMANE-OHNUKI N, SATOH M. Production of therapeutic antibodies with controlled fucosylation[J]. MAbs, 2009, 1(3): 230-236.
[DOI]
|
| [38] |
YAMANE-OHNUKI N, KINOSHITA S, INOUE-URAKUBO M, et al. Establishment of FUT8 knockout Chinese hamster ovary cells: an ideal host cell line for producing completely defucosylated antibodies with enhanced antibody-dependent cellular cytotoxicity[J]. Biotechnol Bioeng, 2004, 87(5): 614-622.
[DOI]
|
| [39] |
BECK A, REICHERT J M. Marketing approval of mogamulizumab: a triumph for glyco-engineering[J]. MAbs, 2012, 4(4): 419-425.
[DOI]
|
| [40] |
CERQUOZZI S, OWEN C. Clinical role of obinutuzumab in the treatment of naive patients with chronic lymphocytic leukemia[J]. Biologics, 2015, 9: 13-22.
|
| [41] |
MÖSSNER E, BRÜNKER P, MOSER S, et al. Increasing the efficacy of CD20 antibody therapy through the engineering of a new type Ⅱ anti-CD20 antibody with enhanced direct and immune effector cell-mediated B-cell cytotoxicity[J]. Blood, 2010, 115(22): 4393-4402.
[DOI]
|
| [42] |
NIEDERFELLNER G, LAMMENS A, MUNDIGL O, et al. Epitope characterization and crystal structure of GA101 provide insights into the molecular basis for type Ⅰ/Ⅱ distinction of CD20 antibodies[J]. Blood, 2011, 118(2): 358-367.
[DOI]
|
| [43] |
WANG L X, TONG X, LI C, et al. Glycoengineering of antibodies for modulating functions[J]. Annu Rev Biochem, 2019, 88: 433-459.
[DOI]
|
| [44] |
HOLLAND M, TAKADA K, OKUMOTO T, et al. Hypogalactosylation of serum IgG in patients with ANCA-associated systemic vasculitis[J]. Clin Exp Immunol, 2002, 129(1): 183-190.
[DOI]
|
| [45] |
ARNOLD J N, WORMALD M R, SIM R B, et al. The impact of glycosylation on the biological function and structure of human immunoglobulins[J]. Annu Rev Immunol, 2007, 25: 21-50.
[DOI]
|
| [46] |
LAZAR G A, DANG W, KARKI S, et al. Engineered antibody Fc variants with enhanced effector function[J]. Proc Natl Acad Sci U S A, 2006, 103(11): 4005-4010.
[DOI]
|
| [47] |
HORTON H M, BERNETT M J, PONG E, et al. Potent in vitro and in vivo activity of an Fc-engineered anti-CD19 monoclonal antibody against lymphoma and leukemia[J]. Cancer Res, 2008, 68(19): 8049-8057.
[DOI]
|
| [48] |
RICHARDS J O, KARKI S, LAZAR G A, et al. Optimization of antibody binding to FcgammaRIIa enhances macrophage phagocytosis of tumor cells[J]. Mol Cancer Ther, 2008, 7(8): 2517-2527.
[DOI]
|
| [49] |
STAVENHAGEN J B, GORLATOV S, TUAILLON N, et al. Fc optimization of therapeutic antibodies enhances their ability to kill tumor cells in vitro and controls tumor expansion in vivo via low-affinity activating Fcgamma receptors[J]. Cancer Res, 2007, 67(18): 8882-8890.
[DOI]
|
| [50] |
IDUSOGIE E E, WONG P Y, PRESTA L G, et al. Engineered antibodies with increased activity to recruit complement[J]. J Immunol, 2001, 166(4): 2571-2575.
[DOI]
|
| [51] |
MELIS J P, STRUMANE K, RUULS S R, et al. Complement in therapy and disease: regulating the complement system with antibody-based therapeutics[J]. Mol Immunol, 2015, 67(2 Pt A): 117-130.
|
| [52] |
DALL'ACQUA W F, COOK K E, DAMSCHRODER M M, et al. Modulation of the effector functions of a human IgG1 through engineering of its hinge region[J]. J Immunol, 2006, 177(2): 1129-1138.
[DOI]
|
| [53] |
TAMMEN A, DERER S, SCHWANBECK R, et al. Monoclonal antibodies against epidermal growth factor receptor acquire an ability to kill tumor cells through complement activation by mutations that selectively facilitate the hexamerization of IgG on opsonized cells[J]. J Immunol, 2017, 198(4): 1585-1594.
[DOI]
|
| [54] |
SENSEL M G, KANE L M, MORRISON S L. Amino acid differences in the N-terminus of C(H)2 influence the relative abilities of IgG2 and IgG3 to activate complement[J]. Mol Immunol, 1997, 34(14): 1019-1029.
[DOI]
|
| [55] |
MOORE G L, CHEN H, KARKI S, et al. Engineered Fc variant antibodies with enhanced ability to recruit complement and mediate effector functions[J]. MAbs, 2010, 2(2): 181-189.
[DOI]
|
| [56] |
KELLNER C, DERER S, VALERIUS T, et al. Boosting ADCC and CDC activity by Fc engineering and evaluation of antibody effector functions[J]. Methods, 2014, 65(1): 105-113.
[DOI]
|
| [57] |
DAVIES A M, JEFFERIS R, SUTTON B J. Crystal structure of deglycosylated human IgG4-Fc[J]. Mol Immunol, 2014, 62(1): 46-53.
[DOI]
|
| [58] |
WANG X H, MATHIEU M, BREZSKI R J. IgG Fc engineering to modulate antibody effector functions[J]. Protein Cell, 2018, 9(1): 63-73.
[DOI]
|
| [59] |
SHI R, SHAN C, DUAN X M, et al. A human neutralizing antibody targets the receptor-binding site of SARS-CoV-2[J]. Nature, 2020, 584(7819): 120-124.
[DOI]
|
| [60] |
AN Z Q, FORREST G, MOORE R, et al. IgG2m4, an engineered antibody isotype with reduced Fc function[J]. MAbs, 2009, 1(6): 572-579.
[DOI]
|
| [61] |
LEABMAN M K, MENG Y G, KELLEY R F, et al. Effects of altered FcγR binding on antibody pharmacokinetics in cynomolgus monkeys[J]. mAbs, 2013, 5(6): 896-903.
[DOI]
|
| [62] |
DIEBOLDER C A, BEURSKENS F J, DE JONG R N, et al. Complement is activated by IgG hexamers assembled at the cell surface[J]. Science, 2014, 343(6176): 1260-1263.
[DOI]
|
| [63] |
MIMOTO F, KATADA H, KADONO S, et al. Engineered antibody Fc variant with selectively enhanced FcγRⅡb binding over both FcγRⅡa(R131) and FcγRⅡa(H131)[J]. Protein Eng Des Sel, 2013, 26(10): 589-598.
[DOI]
|
| [64] |
CHU S Y, VOSTIAR I, KARKI S, et al. Inhibition of B cell receptor-mediated activation of primary human B cells by coengagement of CD19 and FcgammaRIIb with Fc-engineered antibodies[J]. Mol Immunol, 2008, 45(15): 3926-3933.
[DOI]
|
| [65] |
WOZNIAK-KNOPP G, STADLMANN J, RÜKER F. Stabilisation of the Fc fragment of human IgG1 by engineered intradomain disulfide bonds[J]. PLoS One, 2012, 7(1): e30083.
[DOI]
|
| [66] |
LOBNER E, TRAXLMAYR M W, OBINGER C, et al. Engineered IgG1-Fc—one fragment to bind them all[J]. Immunol Rev, 2016, 270(1): 113-131.
[DOI]
|
| [67] |
TRAXLMAYR M W, LOBNER E, ANTES B, et al. Directed evolution of Her2/neu-binding IgG1-Fc for improved stability and resistance to aggregation by using yeast surface display[J]. Protein Eng Des Sel, 2013, 26(4): 255-265.
[DOI]
|
| [68] |
WOZNIAK-KNOPP G, BARTL S, BAUER A, et al. Introducing antigen-binding sites in structural loops of immunoglobulin constant domains: Fc fragments with engineered HER2/neu-binding sites and antibody properties[J]. Protein Eng Des Sel, 2010, 23(4): 289-297.
[DOI]
|
| [69] |
LOBNER E, HUMM A S, GÖRITZER K, et al. Fcab-HER2 interaction: a ménage à trois. Lessons from X-ray and solution studies[J]. Structure, 2017, 25(6): 878-889.e5.
[DOI]
|
| [70] |
SCHÄFER A, MUECKSCH F, LORENZI J C C, et al. Antibody potency, effector function, and combinations in protection and therapy for SARS-CoV-2 infection in vivo[J]. J Exp Med, 2021, 218(3): e20201993.
[DOI]
|
| [71] |
HILLEMAN M R, WERNER J H, GAULD R L. Influenza antibodies in the population of the USA; an epidemiological investigation[J]. Bull World Health Organ, 1953, 8(5-6): 613-631.
|
| [72] |
LU C L, MURAKOWSKI D K, BOURNAZOS S, et al. Enhanced clearance of HIV-1-infected cells by broadly neutralizing antibodies against HIV-1 in vivo[J]. Science, 2016, 352(6288): 1001-1004.
[DOI]
|
| [73] |
BOURNAZOS S, DILILLO D J, RAVETCH J V. The role of Fc-FcγR interactions in IgG-mediated microbial neutralization[J]. J Exp Med, 2015, 212(9): 1361-1369.
[DOI]
|
| [74] |
DILILLO D J, PALESE P, WILSON P C, et al. Broadly neutralizing anti-influenza antibodies require Fc receptor engagement for in vivo protection[J]. J Clin Invest, 2016, 126(2): 605-610.
[DOI]
|
| [75] |
DILILLO D J, TAN G S, PALESE P, et al. Broadly neutralizing hemagglutinin stalk-specific antibodies require FcγR interactions for protection against influenza virus in vivo[J]. Nat Med, 2014, 20(2): 143-151.
[DOI]
|
| [76] |
BOURNAZOS S, CORTI D, VIRGIN H W, et al. Fc-optimized antibodies elicit CD8 immunity to viral respiratory infection[J]. Nature, 2020, 588(7838): 485-490.
[DOI]
|
| [77] |
PICCOLI L, PARK Y J, TORTORICI M A, et al. Mapping neutralizing and immunodominant sites on the SARS-CoV-2 spike receptor-binding domain by structure-guided high-resolution serology[J]. Cell, 2020, 183(4): 1024-1042.e21.
[DOI]
|
| [78] |
XU D L, ALEGRE M L, VARGA S S, et al. In vitro characterization of five humanized OKT3 effector function variant antibodies[J]. Cell Immunol, 2000, 200(1): 16-26.
[DOI]
|
| [79] |
GILCHUK P, MURIN C D, CROSS R W, et al. Pan-ebolavirus protective therapy by two multifunctional human antibodies[J]. Cell, 2021, 184(22): 5593-5607.e18.
[DOI]
|
| [80] |
SAUNDERS K O. Conceptual approaches to modulating antibody effector functions and circulation half-life[J]. Front Immunol, 2019, 10: 1296.
[DOI]
|
 2024, Vol. 31
2024, Vol. 31


