急性A型主动脉夹层(acute type A aortic dissection, AAAD)是一种危及生命的心血管急症,如果没有早期诊断和及时干预,发病早期的死亡率很高[1]。血管平滑肌细胞是主动脉中膜的主要细胞,在维持正常主动脉壁的生物力学特性及病理性主动脉重塑中均发挥关键作用。
整合素是由α和β亚单位组成的异二聚体,发挥促进细胞与胞外基质(extracellular matrix, ECM)结合的作用[1]。整合素参与多种疾病发生过程中细胞内和细胞外信号的传递,包括恶性肿瘤、心血管疾病和自身免疫性疾病等[2]。整合素α5β1高表达可促进多种肿瘤(如肺癌和黑素瘤)转移[3-4],但在乳腺癌和结肠癌细胞系中发挥抑制生长的作用[5-6]。整合素α5β1为黏着斑激酶(focal adhesion kinase, FAK)的上游因子。由于缺乏酪氨酸激酶活性,整合素α5β1通过非受体酪氨酸激酶(如FAK)将细胞外信号传递到细胞内信号[7]。
整合素α5β1作为目前唯一已知的α5整合素,参与促血管生成[8],但其在AAAD中的表达改变及作用尚不清楚。本研究通过分析AAAD患者病变组织整合素α5β1的表达,并观察下调人主动脉平滑肌细胞(human aortic smooth cell, HASMC)中整合素α5β1的表达后HASMC的活性,探讨整合素α5β1在AAAD形成中的作用及可能机制。
1 材料与方法 1.1 AAAD夹层病变部位血管获取选择1例AAAD患者(女性,55岁),经其知情同意,手术切除时获取主动脉夹层病变血管(图 1)和主动脉夹层病变周围健康血管标本,用于后续整合素α5β1表达的检测。

|
| 图 1 AAAD患者病变血管标本 患者女性,55岁,因“持续性后背部疼痛8 h”入院,既往有高血压病,行口服降压药物治疗,血压控制欠佳。A:病变动脉全层;B:病变动脉中膜;C:病变动脉内膜和外膜。 |
HASMC和平滑肌细胞专用培养基购于美国ScienCellTM Research Laboratories公司。抗体包括人抗整合素α5抗体(Ab150361,Abcam公司)、人抗整合素β1抗体(Ab179471,Abcam公司)、抗血管内皮生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR2)抗体(Ab233694,Abcam公司)、抗磷酸化FAK(Tyr576/577)抗体(Ab3281,CST公司)、抗FAK单克隆抗体(Ab66258,Proteintech公司)、抗Caspase 3抗体(Ab19677,Proteintech公司)、抗BAX单克隆抗体(Ab60267,Proteintech公司)、抗BCL2单克隆抗体(Ab60178,Proteintech公司)、抗GAPDH抗体(Ab60004,Proteintech公司)、Alexa Fluor 488 AffiniPure山羊抗鼠IgG(33206ES60,Yeasen公司)及Alexa Fluor 594 AffiniPure山羊抗兔IgG(33112ES60,Yeasen公司)。其他化学品和试剂均购自Sigma公司。
1.3 免疫组化测定AAAD病变组织和正常组织蛋白水平所有标本经固定后,常规脱水、石蜡包埋,以4~5 μm连续切片,H-E染色。选取典型病变区域,进行免疫组化染色,中性树胶封片,采用Image-Pro Plus 6.0(Media Cybernetics)软件分析整合素α5、整合素β1、磷酸化FAK(p-FAK)、VEGFR2和Caspase 3的蛋白表达率。
1.4 免疫荧光检测HASMC中整合素α5、整合素β1和FAK的表达和定位HASMC生长24 h后,弃培养基,PBS洗涤3次;室温下将细胞固定15 min后,PBS清洗3次,4%多聚甲醛固定;室温下,用1%的BSA封闭细胞30 min。一抗4℃孵育过夜,PBS洗涤3次,加入二抗,室温避光孵育60 min,PBS冲洗3次;室温下用DAPI染色10 min,PBS洗涤,加入荧光猝灭剂,密封,在显微镜下摄片。
1.5 siRNA转染下调HASMC中整合素α5、整合素β1的表达水平用Lipofectamine 2000转染试剂(11668-019,Invitrogen公司)将20 µmol/L siRNA(引物序列见表 1、表 2)转染HASMC(6孔板;细胞密度5×104/孔);24 h后,去除转染混合物,换用HASMC专用培养基,继续培养48 h。
| 名称 | F(5′-3′) | R(5′-3′) |
| siRNA-NC | UUCUCCGAACGUGUCACGUTT | ACGUGACACGUUCGGAGAATT |
| siRNA-615 | CACCCGAAUUCUGGAGUAUTT | AUACUCCAGAAUUCGGGUGTT |
| siRNA-733 | GGACCAGGAAGCUAUUUCUTT | AGAAAUAGCUUCCUGGUCCTT |
| siRNA-1329 | GCAGGGAGUAGUGUUUGUATT | UACAAACACUACUCCCUGCTT |
| 名称 | F(5′-3′) | R(5′-3′) |
| siRNA-NC | UUCUCCGAACGUGUCACGUTT | ACGUGACACGUUCGGAGAATT |
| siRNA-474 | GGCUCCAAAGAUAUAAAGATT | UCUUUAUAUCUUUGGAGCCTT |
| siRNA-2172 | GCCUUCAAUAAAGGAGAAATT | UUUCUCCUUUAUUGAAGGCTT |
| siRNA-2504 | GGAGUUUGCUAAAUUUGAATT | UUCAAAUUUAGCAAACUCCTT |
用TRIzol试剂(15596026,Invitrogen公司)提取HASMC总RNA。引物序列为整合素α5-F:5′-CAGCCTTGCCAGAGATCCAA-3′;整合素α5-R:5′-TCCTTGTGTGGCATCTGTCC-3′。整合素β1-F:5′-TGCAACAGCTCTCACCTACG-3′;整合素β1-R:5′-ACAGTGGTCTGTTATGGCACT-3′。GAPDH-F:5′-GGAGCGAGATCCCTCCAA-AAT-3′;GAPDH-R:5′-GGCTGTTGTCAT-ACTTCTCATGG-3′。转录溶液包含1 µg总RNA、10 μL 2×SYBR Green Ⅰ试剂、4 U Multi-Scribe反转录酶、5 U RNase抑制剂和0.5 mmol/L引物的10 μL,50℃ 2 min,95℃ 10 min,95℃ 15 s循环40个周期,60℃ 1 min。
1.7 免疫印迹实验检测整合素α5、整合素β1蛋白表达水平用放射免疫沉淀分析(RIPA)裂解缓冲液(Sangon Biotech,中国)从HASMC中提取总蛋白,用BCA蛋白检测试剂盒检测蛋白浓度。电泳后,在4℃条件下,一抗孵育过夜,抗整合素α5抗体、抗整合素β1抗体、FAK单克隆抗体、抗VEGFR2抗体、磷酸FAK抗体及GAPDH抗体孵育2 h。采用电化学发光(ECL)检测试剂盒检测条带灰度值。
1.8 流式细胞仪检测HASMC的细胞凋亡率Annexin Ⅴ-异硫氰酸荧光素/碘化丙啶(FITC/PI)细胞凋亡检测试剂盒购自碧云天生物技术有限公司。收集HASMC,PBS洗涤2次,与Annexin Ⅴ抗体4℃避光孵育30 min,加入10 μL PI溶液对细胞进行染色,室温避光培养10~20 min。用BD-FACSCanto Ⅱ流式细胞仪上进行检测,荧光显微镜下观察细胞,其中Annexin Ⅴ-FITC呈绿色荧光、PI呈红色荧光。
1.9 CCK-8实验检测HASMC的增殖活力CCK-8试剂盒购自碧云天生物技术有限公司。将100 µL细胞以5×103密度接种于96孔培养板中,培养24 h。细胞贴壁后转染整合素α5β1 siRNA,37℃培养箱中培养48 h;每个孔中添加10 μL CCK-8溶液,继续培养4 h;450 nm检测每个孔中细胞的光密度(D)值,计算细胞存活率。
1.10 统计学处理采用SPSS 20.0软件进行统计学分析。两组间计量资料的比较采用t检验;多组计量资料的比较采用单因素方差分析,采用Bonferroni检验校正。检验水准(α)为0.05。
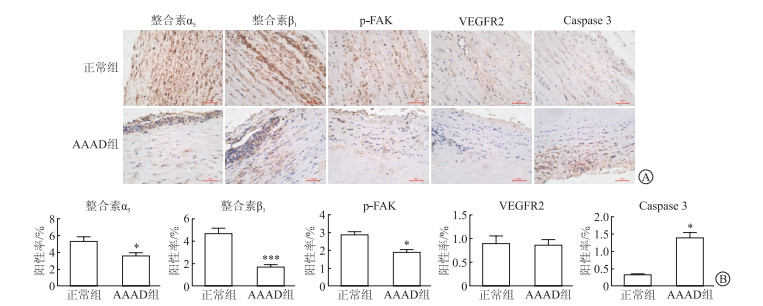
2 结果 2.1 AAAD患者病变组织中整合素α5β1表达免疫组化检测结果(图 2)显示:AAAD患者病变组织整合素α5、整合素β1和p-FAK水平降低,Caspase 3水平升高(P<0.05)。
|
| 图 2 AAAD标本免疫组化检测结果 A:免疫组化染色,Original magnification: ×200;B:Image-Pro Plus 6.0定量分析,n=3, x±s;*P<0.05,***P<0.001。 |
免疫荧光检测结果(图 3)显示:整合素α5、整合素β1和FAK在HASMC中的定位相同,都位于跨细胞膜及胞内。

|
| 图 3 免疫荧光检测整合素α5、整合素β1和FAK的表达和定位 Original magnification: ×200。 |
结果(图 4)显示:与对照组相比,siRNA-615对整合素α5 mRNA和蛋白表达的干扰效果最佳(P<0.01),siRNA-2504对整合素β1 mRNA和蛋白表达的干扰效果最佳(P<0.001)。

|
| 图 4 siRNA干扰整合素α5β1的表达 A:qRT-PCR;B:免疫印迹实验。n=3, x±s; *P<0.05, **P<0.01, ***P<0.001与对照组相比。 |
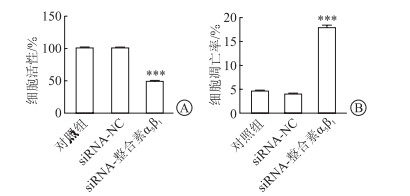
结果(图 5)显示:与对照组相比,用整合素α5β1 siRNA转染HASMC 48 h后,HASMC的存活率显著降低、凋亡率显著升高(P<0.001)。
|
| 图 5 CCK-8实验和流式细胞仪检测HASMCs细胞活性和凋亡率 A:CCK-8实验;B:流式细胞仪检测及定量结果。n=3, x±s;***P<0.001与对照组相比。 |
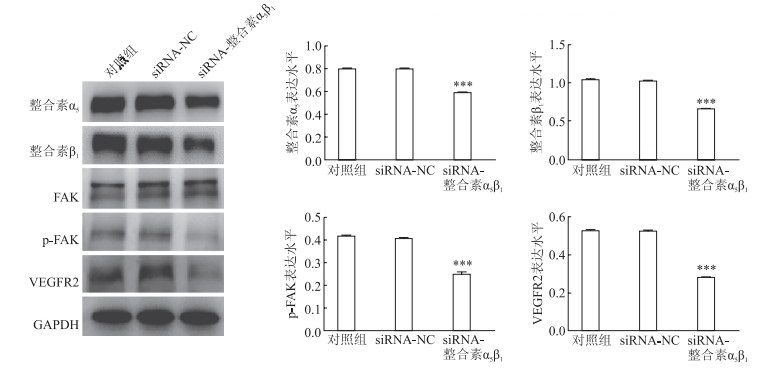
免疫印迹结果(图 6)显示:与对照组相比,用整合素α5β1 siRNA转染HASMC 48 h后,HASMC中整合素α5、整合素β1、p-FAK和VEGFR2蛋白表达均降低(P<0.001)。
|
| 图 6 免疫印迹检测整合素α5β1/FAK通路蛋白的表达 FAK:黏着斑激酶;p-FAK:磷酸化黏着斑激酶;VEGFR2:抗血管内皮生长因子受体2。n=3, x±s; ***P<0.001与对照组相比。 |
HASMC存在于主动脉中层,对于维持主动脉内环境稳定及血管张力有重要作用[9]。平滑肌细胞在健康主动脉中以分化、收缩、非增殖状态存在,并呈现拉长的类似心肌细胞的形态。分化的平滑肌细胞表达一系列平滑肌特异性收缩蛋白和细胞骨架蛋白,如平滑肌肌动蛋白α2(actin alpha 2, ACTA2)、SM22、TAGLN、钙结合蛋白1 (calponin 1, CNN1)、钙调蛋白(calmodulin,CaM)和SMTN、SM肌球蛋白重链11 (myosin heavy chain 11, MYH11)蛋白,这些蛋白对保持动脉壁完整发挥重要作用[10]。动脉损伤后HASMC的激活与细胞外基质(extracellular matrix, ECM)成分的变化有关,如层黏连蛋白和其他基底膜结构的表达下降,中膜和内膜增殖细胞周围出现大量纤维连接蛋白和卵黄连接蛋白沉积[11-12]。整合素可调节细胞与细胞以及细胞与ECM之间的相互作用。此外,HASMC表达包括整合素α5β1在内的多种整合素。多种机制调节HASMC中整合素α5β1的双向信号转导,使HASMC增殖、迁移或凋亡。平滑肌细胞的黏附、增殖和迁移受整合素与ECM成分相互作用的调节[13]。本研究中,用siRNA下调HASMC中整合素α5和整合素β1的表达后,HASMC的增殖减少、凋亡增加。
整合素α5在人类脉管系统发育中起关键作用[14]。有研究[15]证实,干细胞整合素α5基因缺失的小鼠胚胎在第9天出现明显缺陷,第10~11天死亡,并证实整合素α5β1在中胚层形成中发挥重要作用。缺乏整合素α5β1的小鼠胚胎卵黄囊和胚胎本身的血管发育有缺陷,组织血管模式的复杂性下降[16],甚至影响心脏及大动脉的形成[17]。研究[18]发现,上调血管平滑肌细胞整合素α5β1的表达后,平滑肌细胞可从中膜迁移至内膜并增殖,这或为动脉粥样硬化病变发生机制之一。冠状动脉的平滑肌细胞中整合素α5β1表达水平明显低于非冠状动脉平滑肌细胞。
多项研究[19-24]证实,整合素α5β1在多种肿瘤表达上调,并参与肿瘤血管生成和转移。然而,另有研究[25]表明,腹主动脉瘤主动脉组织中整合素α5β1的活性降低,支持本研究结果。整合素α5β1活性降低可能影响腹主动脉结构稳定性,进而导致主动脉畸形和腹主动脉瘤形成。阻断猪颈动脉平滑肌细胞中整合素α5β1的表达可抑制其增殖[10]。在大鼠平滑肌细胞中,整合素α5β1表达增加可以增强平滑肌细胞的黏附、迁移和增殖[26]。在缺乏整合素α5表达的C57BL/6小鼠内皮细胞中,促进脑缺氧时脑内皮细胞的增殖有利于血管生成[27]。这些结果证实整合素α5β1在血管疾病,尤其是动脉瘤发生中起重要作用。此外,整合素α5β1参与多种非血管性疾病,如免疫性疾病[28]、类风湿性关节炎[29]、哮喘[30]等。
AAAD的发病机制之一可能为血管内皮生长因子(vascular endothelial growth factor,VEGF)介导的血管生成。VEGF可促进血管生成,也具有促炎症作用。VEGF在主动脉新生血管及其周围的免疫炎症浸润的部位表达增加。整合素α5β1作为一种促血管生成因子,通过与VEGFR相互作用,参与调节多种病变中血管的生成。本研究中,AAAD患者病变样本中,整合素α5β1表达显著下调。FAK定位于健康动脉的平滑肌细胞。AAAD患者血管损伤后通过整合素α5β1,促进FAK易位并激活,进而通过VEGFR促进主动脉平滑肌细胞活性改变。本研究中,下调整合素α5β1表达后,FAK表达及磷酸化水平降低,VEGFR2表达降低,推测整合素α5β1/FAK信号通路参与AAAD的发生。
综上所述,本研究证实了整合素α5β1在AAAD病变组织中表达下降,并可能参与HASMC的存活与凋亡;下调整合素α5β1后,整合素α5β1/FAK信号通路中的蛋白表达降低,这可能是AAAD发生的机制之一。因此,深入探讨整合素α5β1及其他整合素在HASMC生物学中的作用机制,能为进一步了解主动脉夹层发病机制及寻找新的诊断和治疗靶点提供思路。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
DESGROSELLIER J S, CHERESH D A. Integrins in cancer: biological implications and therapeutic opportunities[J]. Nat Rev Cancer, 2010, 10(1): 9-22.
[DOI]
|
| [2] |
SCHWARTZ M A, GINSBERG M H. Networks and crosstalk: integrin signalling spreads[J]. Nat Cell Biol, 2002, 4(4): E65-E68.
[DOI]
|
| [3] |
ADACHI M, TAKI T, HIGASHIYAMA M, et al. Significance of integrin alpha5 gene expression as a prognostic factor in node-negative non-small cell lung cancer[J]. Clin Cancer Res, 2000, 6(1): 96-101.
|
| [4] |
RYU S H, HEO S H, PARK E Y, et al. Selumetinib inhibits melanoma metastasis to mouse liver via suppression of EMT-targeted genes[J]. Anticancer Res, 2017, 37(2): 607-614.
[DOI]
|
| [5] |
MOROZEVICH G E, KOZLOVA N I, USHAKOVA N A, et al. Implication of integrin alpha5beta1 in human breast carcinoma apoptosis and drug resistance[J]. Biomed Khim, 2011, 57(1): 77-84.
[DOI]
|
| [6] |
TOQUET C, COLSON A, JARRY A, et al. ADAM15 to α5β1 integrin switch in colon carcinoma cells: a late event in cancer progression associated with tumor dedifferentiation and poor prognosis[J]. Int J Cancer, 2012, 130(2): 278-287.
[DOI]
|
| [7] |
WEI L Y, CHEN Q, ZHENG Y, et al. Potential role of integrin α5β1/focal adhesion kinase (FAK) and actin cytoskeleton in the mechanotransduction and response of human gingival fibroblasts cultured on a 3-dimension lactide-Co-glycolide (3D PLGA) scaffold[J]. Med Sci Monit, 2020, 26: e921626.
|
| [8] |
PACIFICI R, BASILICO C, ROMAN J, et al. Collagen-induced release of interleukin 1 from human blood mononuclear cells. Potentiation by fibronectin binding to the alpha 5 beta 1 integrin[J]. J Clin Invest, 1992, 89(1): 61-67.
[DOI]
|
| [9] |
JAIN M, CHAUHAN A K. Role of integrins in modulating smooth muscle cell plasticity and vascular remodeling: from expression to therapeutic implications[J]. Cells, 2022, 11(4): 646.
[DOI]
|
| [10] |
ALLAHVERDIAN S, CHAABANE C, BOUKAIS K, et al. Smooth muscle cell fate and plasticity in atherosclerosis[J]. Cardiovasc Res, 2018, 114(4): 540-550.
[DOI]
|
| [11] |
THYBERG J, BLOMGREN K, ROY J, et al. Phenotypic modulation of smooth muscle cells after arterial injury is associated with changes in the distribution of laminin and fibronectin[J]. J Histochem Cytochem, 1997, 45(6): 837-846.
[DOI]
|
| [12] |
HEDIN U, BOTTGER B A, FORSBERG E, et al. Diverse effects of fibronectin and laminin on phenotypic properties of cultured arterial smooth muscle cells[J]. J Cell Biol, 1988, 107(1): 307-319.
[DOI]
|
| [13] |
MOISEEVA E P. Adhesion receptors of vascular smooth muscle cells and their functions[J]. Cardiovasc Res, 2001, 52(3): 372-386.
[DOI]
|
| [14] |
HYNES R O. Cell-matrix adhesion in vascular development[J]. J Thromb Haemost, 2007, 5(Suppl 1): 32-40.
|
| [15] |
YANG J T, RAYBURN H, HYNES R O. Embryonic mesodermal defects in alpha 5 integrin-deficient mice[J]. Development, 1993, 119(4): 1093-1105.
[DOI]
|
| [16] |
FRANCIS S E, GOH K L, HODIVALA-DILKE K, et al. Central roles of alpha5beta1 integrin and fibronectin in vascular development in mouse embryos and embryoid bodies[J]. Arterioscler Thromb Vasc Biol, 2002, 22(6): 927-933.
[DOI]
|
| [17] |
MITTAL A, PULINA M, HOU S Y, et al. Fibronectin and integrin alpha 5 play requisite roles in cardiac morphogenesis[J]. Dev Biol, 2013, 381(1): 73-82.
[DOI]
|
| [18] |
DAVENPECK K L, MARCINKIEWICZ C, WANG D, et al. Regional differences in integrin expression: role of alpha(5)beta(1) in regulating smooth muscle cell functions[J]. Circ Res, 2001, 88(3): 352-358.
[DOI]
|
| [19] |
HOU J B, YAN D, LIU Y D, et al. The roles of integrin α5β1 in human cancer[J]. Onco Targets Ther, 2020, 13: 13329-13344.
[DOI]
|
| [20] |
GONG C, YANG Z Y, WU F H, et al. miR-17 inhibits ovarian cancer cell peritoneal metastasis by targeting ITGA5 and ITGB1[J]. Oncol Rep, 2016, 36(4): 2177-2183.
[DOI]
|
| [21] |
SONONGBUA J, SIRITUNGYONG S, THONGCHOT S, et al. Periostin induces epithelial-to-mesenchymal transition via the integrin α5β1/TWIST-2 axis in cholangiocarcinoma[J]. Oncol Rep, 2020, 43(4): 1147-1158.
|
| [22] |
DUDVARSKI STANKOVIĆ N, BICKER F, KELLER S, et al. EGFL7 enhances surface expression of integrin α5β1 to promote angiogenesis in malignant brain tumors[J]. EMBO Mol Med, 2018, 10(9): e8420.
[DOI]
|
| [23] |
HUANG R X, ROFSTAD E K. Integrins as therapeutic targets in the organ-specific metastasis of human malignant melanoma[J]. J Exp Clin Cancer Res, 2018, 37(1): 92.
[DOI]
|
| [24] |
ROCHA L A, LEARMONTH D A, SOUSA, et al. αvβ3 and α5β1 integrin-specific ligands: from tumor angiogenesis inhibitors to vascularization promoters in regenerative medicine?[J]. Biotechnol Adv, 2018, 36(1): 208-227.
[DOI]
|
| [25] |
CHEUK B L Y, CHENG S W K. Differential expression of integrin alpha5beta1 in human abdominal aortic aneurysm and healthy aortic tissues and its significance in pathogenesis[J]. J Surg Res, 2004, 118(2): 176-182.
[DOI]
|
| [26] |
LIU H, DONG W P, LIN Z Q, et al. CCN4 regulates vascular smooth muscle cell migration and proliferation[J]. Mol Cells, 2013, 36(2): 112-118.
[DOI]
|
| [27] |
LI L X, WELSER-ALVES J, VAN DER FLIER A, et al. An angiogenic role for the α5β1 integrin in promoting endothelial cell proliferation during cerebral hypoxia[J]. Exp Neurol, 2012, 237(1): 46-54.
[DOI]
|
| [28] |
EVANS R, PATZAK I, SVENSSON L, et al. Integrins in immunity[J]. J Cell Sci, 2009, 122(Pt 2): 215-225.
|
| [29] |
LOWIN T, STRAUB R H. Integrins and their ligands in rheumatoid arthritis[J]. Arthritis Res Ther, 2011, 13(5): 244.
[DOI]
|
| [30] |
SUNDARAM A, CHEN C, KHALIFEH-SOLTANI A, et al. Targeting integrin alpha5beta1 ameliorates severe airway hyperresponsiveness in experimental asthma[J]. J Clin Invest, 2017, 127(1): 365-374.
|
 2023, Vol. 30
2023, Vol. 30


