脓毒症作为一类复杂性、异质性较高的临床综合征,在疾病进展过程中,抗炎及促炎剧烈的双相、拮抗反应促使机体免疫失衡及免疫抑制,导致脏器损伤进行性加重,甚至导致患者死亡[1]。T淋巴细胞耗竭是脓毒症免疫抑制的主要特征[2]。因此,明确疾病进程中淋巴细胞亚群变化,对于推进逆转脓毒症免疫抑制干预方法发展有重要作用。
以往研究中,脓毒症免疫相关指标多来源于患者或动物模型的血液,而血液为炎症高反应和免疫抑制的混合环境[3]。而且,由于难以通过临床患者实现对脏器免疫反应的动态观察,有关脓毒症疾病进程中T细胞亚群变化、血液及不同组织中细胞因子释放水平的动态研究相对较少。而深入研究脓毒症发展过程中脏器炎症浸润程度与免疫平衡的变化关系,通过T细胞亚群及炎症因子水平评估脏器损伤严重程度及疾病进展情况,能为临床更早启动对脓毒症患者的脏器保护提供参考。因此,本研究通过小鼠脓毒症模型,探讨脓毒症发展过程中不同组织炎症浸润程度的变化以及不同免疫器官中T细胞亚群的变化。
1 材料与方法 1.1 试剂及仪器Luminex细胞因子检测试剂盒(美国BIO-RAD公司;编号:17004035);Luminex分析仪(美国Luminex公司;型号:X-200)。抗Foxp3-PE(Thermo公司;编号:12-5773-82),抗CD25-PE-Cyn7(Thermo公司;编号:25-0251-82),抗IL-17A-PE(Thermo公司;编号:12-7177-81),抗CD8-PerCP-cy5.5(美国BD公司;编号:551162),抗CD4-FITC(美国BD公司;编号:557307)。流式细胞仪(美国BD公司;型号:Celesta),离心机(Eppendorf公司;型号:5424R)。
1.2 实验对象SPF级健康雄性BALB/c小鼠80只,体质量20~22 g,由上海斯莱克实验动物有限责任公司提供[许可证号:SCXK(沪)2017-0005]。小鼠饲养于上海中医药大学附属岳阳中西医结合医院实验动物中心,温度(22±2)℃,相对湿度(55±2)%,12 h/12 h明暗交替光照,自由饮水摄食。本研究获得上海中医药大学附属岳阳中西医结合医院伦理委员会审批(YYLAC-2021-101-1)。
1.3 分组与造模将80只BALB/c小鼠随机分为假手术组(n=40)及盲肠结扎穿孔术(CLP组,n=40)。造模前两组小鼠均禁食、水8 h,每只小鼠予2%戊巴比妥钠(40 mg/kg,0.04 mL/20 g)腹腔注射麻醉,固定于操作台上,腹部备皮后予常规消毒;CLP组通过CLP建立脓毒症小鼠模型,假手术组开腹后寻找到盲肠后将其回纳腹腔,逐层关腹。术后予每只小鼠背部皮下注射1 mL 37℃预热的生理盐水,行液体复苏治疗。
1.4 取材分别于术后0 h、6 h、12 h、24 h、48 h、72 h进行取材,两组每个时间点各6只小鼠。通过摘除眼球法,用含抗凝剂的采血管收集外周血,离心后取上清,﹣80℃保存血浆。处死小鼠后,依次取出脾脏、肺脏及回肠,予1×PBS清洗。脾脏、部分回肠组织用组织保存液于4℃保存;肺脏及剩余回肠组织各取20 mg放入EP管中,加入200 μL裂解液进行匀浆后,离心取上清,测定BCA总蛋白浓度,﹣80℃保存。
1.5 细胞因子IL-6、IL-10、IL-2、IL-4含量测定采用Luminex细胞因子检测试剂盒及Luminex分析仪分别测定各时间点小鼠血浆、肺组织、回肠组织中细胞因子IL-6、IL-10、IL-2、IL-4的含量。
1.6 淋巴细胞比例测定分别取出各时间点小鼠脾脏、回肠,制成1×107个/mL细胞悬液,按照说明书检测脾脏淋巴细胞Th17、Treg及回肠黏膜固有层中CD4+T细胞、CD8+T细胞比例。回肠黏膜固有层T细胞检测:加入细胞表面荧光抗体,4℃孵育30 min,3 h内用流式细胞仪完成检测。脾脏淋巴细胞检测:加入细胞表面荧光抗体,4℃孵育30 min,完成破膜固定后进行核内染色,混匀后4℃孵育30 min。
1.7 统计学处理采用SPSS 25.0统计软件对数据进行统计分析。满足正态分布及方差齐性的计量资料以x±s描述,组间比较采用one-way ANOVA检验,检验水准(α)为0.05。
2 结果 2.1 血浆IL-6、IL-10、IL-2、IL-4含量结果(图 1)显示:CLP组小鼠术后12 h血浆IL-6、IL-10、IL-2含量达峰值,IL-6/IL-10比值升高,高于与假手术组(P < 0.05)。随后,CLP组小鼠血浆IL-6、IL-10、IL-2呈下降趋势,但仍高于假手术组。CLP组小鼠血浆IL-6水平及IL-6/IL-10比值在术后48 h骤降,与假手术组差异无统计学意义;CLP组术后48 h血浆IL-4含量高于假手术组(P < 0.01)。

|
| 图 1 两组小鼠血浆各炎症因子含量比较 *P < 0.05、**P < 0.01与假手术组相比。 |
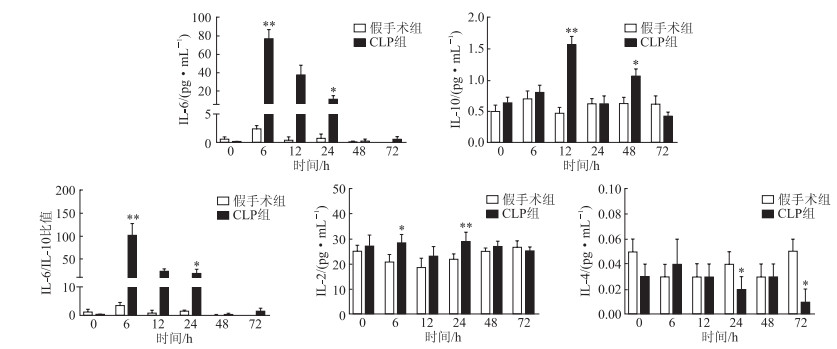
结果(图 2)显示:CLP组小鼠术后6 h肺组织中IL-6水平骤升并达高峰,IL-6/IL-10比值达高峰,高于假手术组(P < 0.01);CLP组小鼠肺组织中IL-10于术后12 h达峰值,高于假手术组(P < 0.01);CLP组小鼠肺组织中术后6 h、24 h IL-2含量均高于假手术组(P < 0.05);CLP组肺组织中术后24 h、72 h IL-4含量低于假手术组(P < 0.05)。
|
| 图 2 两组小鼠肺组织各炎症因子含量比较 *P < 0.05、**P < 0.01与假手术组相比。 |
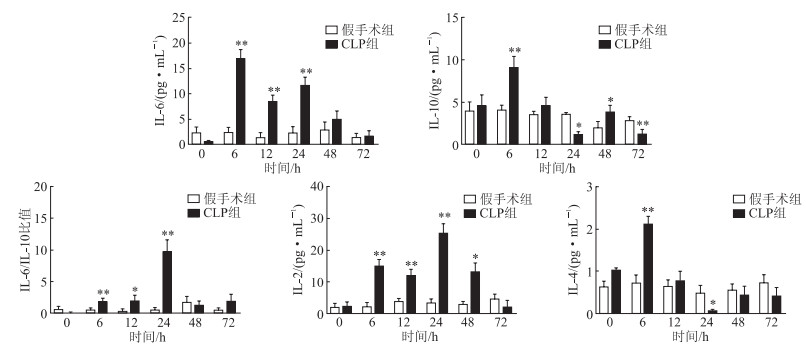
结果(图 3)显示:CLP组小鼠回肠组织中IL-6、IL-10、IL-4含量均于术后6 h达峰值,高于假手术组(P < 0.01);CLP组小鼠回肠组织IL-6/IL-10比值于术后24 h达峰值,高于假手术组(P < 0.01)。回肠组织中IL-10及IL-4在达峰值后明显下降,CLP组术后24 h IL-10、IL-4含量及术后72 h IL-10含量低于假手术组(P < 0.05)。回肠组织中IL-2含量于术后24 h达峰值(P < 0.01),术后72 h低于假手术组。
|
| 图 3 两组小鼠回肠组织炎症因子含量比较 *P < 0.05、**P < 0.01与假手术组相比。 |
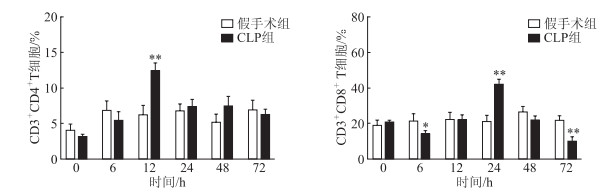
结果(图 4)显示:CLP组小鼠回肠黏膜固有层中CD4+T细胞比例于术后12 h达峰值,CD8+T细胞比例于术后24 h达峰值,均高于同时间点假手术组(P < 0.01)。术后72 h,CLP组小鼠回肠黏膜固有层中CD8+T细胞比例低于假手术组(P < 0.01)。CLP组小鼠术后6 h、术后12 h CD8+/CD4+比值均下降且低于假手术组(P < 0.05),术后24 h上升且高于假手术组(P < 0.01),随后持续下降,术后72 h低于假手术组(P < 0.01,表 1)。
|
| 图 4 两组小鼠回肠黏膜固有层中CD4+、CD8+T淋巴细胞比例比较 *P < 0.05、**P < 0.01与假手术组相比。 |
| 组别 | 术后0 h | 术后6 h | 术后12 h | 术后24 h | 术后48 h | 术后72 h |
| 假手术组 | 5.68±3.98 | 3.52±0.68 | 4.04±0.96 | 3.34±1.07 | 5.51±1.59 | 4.95±0.71 |
| CLP组 | 6.56±0.11 | 2.48±0.59* | 2.01±0.64** | 6.67±1.99** | 3.14±1.3 | 1.88±0.93** |
| *P < 0.05、**P < 0.01与假手术组相比。 | ||||||
结果(图 5)显示:CLP组小鼠术后6 h、24 h脾脏Th17、Treg细胞比例高于同时间点假手术组(P < 0.01),术后24 h后均下降;术后48 h Treg细胞比例低于假手术组(P < 0.05)。CLP组小鼠术后6 h、12 h、48 h、72 h Treg/Th17比值均小于假手术组,但差异无统计学意义(表 2)。

|
| 图 5 两组小鼠脾脏Th17、Treg细胞比例比较 *P < 0.05、**P < 0.01与假手术组相比。 |
| 组别 | 术后0 h | 术后6 h | 术后12 h | 术后24 h | 术后48 h | 术后72 h |
| 假手术组 | 12.30±1.82 | 11.58±5.68 | 10.49±3.29 | 11.96±5.15 | 17.22±5.34 | 11.15±2.57 |
| CLP组 | 10.55±2.75 | 7.97±1.87 | 8.22±1.40 | 14.24±2.81 | 12.28±6.91 | 8.38±3.92 |
脓毒症后T细胞稳态被破坏,继而丢失、耗竭,出现亚群间制约及协作功能异常[5],导致机体二重感染率升高,如激活休眠病毒或引发机会性细菌感染[6-7]。相关研究[8]发现,存活脓毒症患者体内CD3+、CD4+T细胞水平明显高于死亡患者,同时CD4+T细胞呈不同程度持续下降趋势。脓毒症小鼠外周血CD3+CD4+/CD3+CD8+比值低于假手术组,而给予参附注射液后升高,且促炎因子下调、抗炎因子上调[9]。李远思等[10]给予脓毒症患者胸腺肽α1后,患者CD3+上升、CD8+下降、CD4+/CD8+升高,与对照组差异有统计学意义(P < 0.05)。上述研究均基于血浆水平。
脓毒症发生早期,肠道黏膜主要通过局部免疫细胞代偿性地发挥免疫调节作用,不依赖于系统免疫[11-12]。随着损伤相关因子持续释放及其他应激信号产生,炎症因子及免疫细胞不断被激活、释放、消耗,迫使肠道微生物环境失衡,并通过通透性异常的机械屏障或肠系膜淋巴管易位至其他部位[13-14]。本研究证实,在脓毒症早期(6~12 h),回肠黏膜固有层中T细胞功能亢进,且以CD4+细胞数量增加为主,表现为CD8+/CD4+比值下降;随后CD4+细胞数量减少、CD8+细胞继续增加,CD8+细胞数量于术后24 h达峰值,随后减少,因此在脓毒症中后期(12~72 h),CD8+/CD4+比值表现为先升后降,提示在脓毒症中后期回肠黏膜固有层中的T淋巴细胞明显损耗,后期以CD8+细胞损耗更明显。本研究中脓毒症小鼠回肠黏膜固有层中CD4+、CD8+T细胞变化特点与上述研究中外周血中T细胞变化相符。
Treg细胞是脓毒症患者免疫反应抑制的重要参与者。Th17与Treg细胞分化间相互影响,功能上相互拮抗,使机体处于免疫平衡状态[15-16]。脓毒症发病过程中,由于Treg抗凋亡能力优于其他T淋巴细胞,随着其他亚群的损耗,Treg比例一般相对升高,可作为脓毒症发生后淋巴细胞增殖能力下降的替代标志物[17-18]。本研究显示,由于剧烈炎症反应及免疫负反馈作用,Th17及Treg在脓毒症早中期(6~24 h)上升,术后24 h以Treg上升更显著,而术后48 h CLP小鼠Th17、Treg均较前下降,甚至低于同时间点假手术组。此外,本研究中小鼠血液、回肠中IL-2均为先升后降,与Treg比例变化趋势相一致,这可能与IL-2通过激活Treg维持免疫耐受[5]有关,证实淋巴细胞的增殖能力受到抑制。上述结果说明尽管Treg抗凋亡能力优于其他免疫细胞亚群,但在脓毒症后期(48~72 h),T淋巴细胞亚群的抑制仍进一步增强。
然而,目前Treg/Th17比值在免疫抑制状态下的变化尚无定论。有研究[19]发现,脓毒症患者序贯器官衰竭评分与Th17、Treg正相关,且Treg/Th17比值明显降低。而存活脓毒症患者Th17细胞比例高于死亡患者,且在早期有更高水平的Th17[20]。本研究中两组各时间点Treg/Th17比值差异无统计学意义,可能与CLP诱导的脓毒症病情较轻有关。后期拟通过建立重症脓毒症动物模型,促发更剧烈的炎症反应和免疫失衡,同时扩大样本量,进一步评估Treg/Th17比值在免疫抑制状态下的变化。
此外,本研究发现,血液及不同组织中炎症因子释放的趋势有差异。其中,肺组织及回肠组织中IL-6的表达峰值出现早于血液。回肠组织中促炎细胞因子IL-2在脓毒症中期(12~24 h)维持较高水平;而血液中IL-2水平在脓毒症早期较高,但在脓毒症中后期后大幅回落。CLP组回肠组织中抗炎细胞因子IL-10、IL-4在术后6 h已明显高于假手术组。该结果说明脓毒症早期,回肠组织中抗炎及促炎反应均剧烈,与早期肠道黏膜固有层中CD4+T细胞比例升高、功能亢进相符合。
本研究还发现,在脓毒症中后期,各血液中细胞因子含量减少,但CLP术后48 h肺组织及回肠组织中IL-10、IL-2仍保持相对较高的水平。该结果表明,尽管脓毒症中后期血液中炎症因子风暴已减弱,但相关脏器、组织仍持续释放抗炎、促炎因子,尤其是肠道黏膜,导致感染及脏器损伤持续存在,这可能是较多患者继发二重感染及多器官功能障碍综合征的重要因素[21]。程鹏飞等[22]利用滋阴活血润肠中药干预后,脓毒症大鼠细胞免疫和体液免疫被激活,促使浆细胞分泌更多抗体(sIgA),肠黏膜屏障得到保护的同时,炎症瀑布反应被控制,病死率降低。
综上所述,本研究证实,脓毒症发病后,小鼠血液及不同脏器之间免疫反应变化趋势存在差异性,以肠道黏膜中炎症反应最亢进且持续时间更长;脓毒症中后期,血液及相关脏器中抗炎、促炎因子分泌减少,CD8+T细胞减少,Treg比例相对较高,提示淋巴细胞增殖能力下降。同时,本研究表明,细胞因子水平下降不能证明疾病好转,结合脏器功能及T淋巴细胞亚群动态变化可能更有助于了解脓毒症发展阶段及机体免疫状态。此外,尽早阻断亢进的肠道黏膜免疫反应、恢复肠道内环境可能是避免发生免疫抑制、尽快逆转脏器损伤的重要手段之一。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
EVANS L, RHODES A, ALHAZZANI W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021[J]. Crit Care Med, 2021, 49(11): e1063-e1143.
[DOI]
|
| [2] |
MARTIN M D, BADOVINAC V P, GRIFFITH T S. CD4 T cell responses and the sepsis-induced immunoparalysis state[J]. Front Immunol, 2020, 11: 1364.
[DOI]
|
| [3] |
CAVAILLON J M. Septic plasma: an immunosuppressive milieu[J]. Am J Respir Crit Care Med, 2002, 166(11): 1417-1418.
[DOI]
|
| [4] |
DEJAGER L, PINHEIRO I, DEJONCKHEERE E, et al. Cecal ligation and puncture: the gold standard model for polymicrobial sepsis?[J]. Trends Microbiol, 2011, 19(4): 198-208.
[DOI]
|
| [5] |
CABRERA-PEREZ J, CONDOTTA S A, BADOVINAC V P, et al. Impact of sepsis on CD4 T cell immunity[J]. J Leukoc Biol, 2014, 96(5): 767-777.
[DOI]
|
| [6] |
DUONG S, CONDOTTA S A, RAI D, et al. Polymicrobial sepsis alters antigen-dependent and-independent memory CD8 T cell functions[J]. J Immunol, 2014, 192(8): 3618-3625.
[DOI]
|
| [7] |
GAO Y L, YAO Y, ZHANG X, et al. Regulatory T cells: angels or demons in the pathophysiology of sepsis?[J]. Front Immunol, 2022, 13: 829210.
[DOI]
|
| [8] |
王月, 徐岩. 重症监护病房脓毒血症患者免疫功能与预后有关[J]. 内科急危重症杂志, 2022, 28(1): 65-67. WANG Y, XU Y. Immune function of sepsis patients in intensive care unit is related to prognosis[J]. Journal of Critical Care in Internal Medicine, 2022, 28(1): 65-67. [CNKI] |
| [9] |
赵锋利, 罗苑苑, 赵馥, 等. 参附注射液调控巨噬细胞自噬对脓毒症小鼠免疫功能影响[J]. 辽宁中医药大学学报, 2019, 21(8): 34-37. ZHAO F L, LUO Y Y, ZHAO F, et al. Effect of Shenfu injection on immune function in septic mice by regulating macrophage autophagy[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2019, 21(8): 34-37. [CNKI] |
| [10] |
李远思, 程玲, 张琦, 等. 胸腺肽α1对脓毒症患者T淋巴细胞及TLR9信号通路的影响[J]. 中华全科医学, 2021, 19(9): 1470-1473. LI Y S, CHENG L, ZHANG Q, et al. Effect of thymosinα1 on T lymphocytes and TLR9 signaling pathway in patients with sepsis[J]. Chin J Gen Pract, 2021, 19(9): 1470-1473. [CNKI] |
| [11] |
TURNER J R. Intestinal mucosal barrier function in health and disease[J]. Nat Rev Immunol, 2009, 9(11): 799-809.
[DOI]
|
| [12] |
AHMAD R, SORRELL M F, BATRA S K, et al. Gut permeability and mucosal inflammation: bad, good or context dependent[J]. Mucosal Immunol, 2017, 10(2): 307-317.
[DOI]
|
| [13] |
CHELAKKOT C, GHIM J, RYU S H. Mechanisms regulating intestinal barrier integrity and its pathological implications[J]. Exp Mol Med, 2018, 50(8): 1-9.
|
| [14] |
MCCONNELL K W, COOPERSMITH C M. Pathophysiology of septic shock: from bench to bedside[J]. Presse Med, 2016, 45(4 Pt 2): e93-e98.
|
| [15] |
BUNTE K, BEIKLER T. Th17 cells and the IL-23/IL-17 axis in the pathogenesis of periodontitis and immune-mediated inflammatory diseases[J]. Int J Mol Sci, 2019, 20(14): E3394.
[DOI]
|
| [16] |
LEE G R. The balance of Th17 versus treg cells in autoimmunity[J]. Int J Mol Sci, 2018, 19(3): 730.
|
| [17] |
VENET F, CHUNG C S, KHEROUF H, et al. Increased circulating regulatory T cells (CD4(+)CD25 (+)CD127 (-)) contribute to lymphocyte anergy in septic shock patients[J]. Intensive Care Med, 2009, 35(4): 678-686.
|
| [18] |
HOTCHKISS R S, MONNERET G, PAYEN D. Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy[J]. Nat Rev Immunol, 2013, 13(12): 862-874.
|
| [19] |
王建峰, 杨楠楠. 脓毒症患者外周血Th1/Th2和Th17/Treg平衡变化及临床意义[J]. 锦州医科大学学报, 2021, 42(2): 86-89. WANG J F, YANG N N. Changes of Th1/Th2 and Th17/Treg balance in peripheral blood of patients with sepsis and their clinical significance[J]. Journal of Jinzhou Medical University, 2021, 42(2): 86-89. [CNKI] |
| [20] |
WU H P, CHUNG K, LIN C Y, et al. Associations of T helper 1, 2, 17 and regulatory T lymphocytes with mortality in severe sepsis[J]. Inflamm Res, 2013, 62(8): 751-763.
|
| [21] |
DE-SOUZA D A, GREENE L J. Intestinal permeability and systemic infections in critically ill patients: effect of glutamine[J]. Crit Care Med, 2005, 33(5): 1125-1135.
|
| [22] |
程鹏飞, 郑爱华. 滋阴活血润肠法对大鼠脓毒血症模型炎症因子及PCT的影响[J]. 中国中医急症, 2019, 28(11): 1938-1941. CHENG P F, ZHENG A H. Effect of Ziyin Huoxue Runchang method on inflammatory factor and PCT in rat sepsis model[J]. Journal of Emergency in Traditional Chinese Medicine, 2019, 28(11): 1938-1941. [CNKI] |
 2022, Vol. 29
2022, Vol. 29


