2. 复旦大学附属中山医院放射科, 上海 200032
2. Department of Radiology, Zhongshan Hospital, Fudan University, Shanghai 200032, China
随着心脏磁共振成像(cardiac magnetic resonance imaging,CMRI)对心脏疾病诊断、风险评估和治疗决策的临床价值得到广泛认可[1],Cine序列作为CMRI的重要环节在心功能分析和心脏疾病诊断中越来越重要。虽然临床上心超的应用远多于CMRI,且心超的斑点追踪技术能有效捕捉心肌运动,但CMRI空间分辨率和软组织分辨率更有优势,同时能顺应心室形态,分析心功能更为可靠,被作为参照标准。
目前三维CMRI图像的人工智能分析和评价也是研究热点。由于Cine序列图像数量多,传统手动分析方法耗时较长,人工智能的发展有望解决这一问题。但是,目前人工智能对于心腔大小和心肌厚度明显异常患者的诊断价值需要更多研究来评价[2-3]。随着深度学习技术的快速发展和广泛应用,卷积神经网络(convolutional neural network, CNN)作为人工智能算法的基础,一直在不断突破自动图像分析的极限[4-5]。然而,全自动心脏分割仍然存在几个难题,例如:心脏运动和机器干扰;乳头肌和心内膜小梁干扰[4-5];心房和心室以及腔室和血管的鉴别。尽管多项研究[6-8]已证明自动心脏分割能胜任CMRI分析,但临床上仍倾向于半自动分割。
左心室功能(LV)与常见心肌病的诊断和治疗密切相关,如肥厚型心肌病(hypertrophic cardiomyopathy,HCM)和扩张型心肌病(dilated cardiomyopathy,DCM)。HCM是年轻人心源性猝死的主要原因,而DCM是心力衰竭的第三常见病因,因此明确不同心肌病心脏自动分割的准确性有重要意义。本研究中旨在比较人工智能和手动方法在分析不同心肌病患者LV功能方面的差异,指出人工智能应用于不同心肌病诊断的优缺点。
1 资料与方法 1.1 一般资料收集2014年3月至2019年11月在复旦大学附属中山医院接受CMRI检查的393例心肌病患者及体检者的临床资料。本研究经伦理委员会批准(B2018-286);研究对象均签署知情同意书。
其中HCM患者125例(HCM组),纳入标准[9-12]:(1)有排除其他导致左心室肥厚的疾病后,CMRI显示左心室肥厚(成人患者最大壁厚≥15 mm,有肥厚型心肌病家族史的患者最大壁厚≥13 mm);(2)心房、心室正常大小,射血分数(EF)>50%。排除标准:(1)有心肌梗死或心肌炎病史;(2)有间隔肌切除术或酒精性间隔消融史;(3)有心房颤动史。
DCM患者133例(DCM组),纳入标准:(1)心超提示EF≤50%;(2)冠状动脉造影、正压超声心动图或心肌灌注扫描未提示明显的梗阻性狭窄(排除缺血性心脏病);(3)在接受CMRI之前症状持续时间超过6周(排除急性心肌炎患者)。排除标准:结节病,HCM,致心律失常性右室发育不良和浸润性心脏病的特异性诊断(如淀粉样变性和淋巴瘤)[13-14]。
健康体检者135例(对照组),均无导致胸闷、胸痛等症状的器质性疾病,同时无代谢或心血管疾病史,体格检查、心电图及超声心动图正常。
1.2 CMRI图像采集所有病例均采用1.5T磁共振扫描仪(MAGNETOMAera,西门子)完成检查,并使用心电图门控和8通道心脏线圈。采用稳态自由进动(SSFP)序列,覆盖整个左心室的短轴切面和长轴切面(包括双腔心和四腔心层面)后获得屏气扫描图像。其中Cine序列参数为重复时间/回波时间(TR/TE)3.2/1.6 ms,翻转角度50°,矩阵256×230,视野(FOV)370 mm×278 mm,采集时间为每层12 s,层厚8 mm。
1.3 CMRI图像分析应用人工智能软件CVI42® 5.3.4进行自动分析。CVI软件自动选定左心室舒张末(ED)和收缩末(ES)时相,并在纵向和短轴Cine图像上自动绘制心内膜和心外膜轮廓。记录自动分析结果后,由两名具有5年以上CMRI评估经验的医师再次以手动方式完成上述步骤[15]。体积计算采用Simpson方法[16]。以手动勾画的结果为标准,评价自动分割方法的准确性。两位医师不被告知受试者情况,若意见出现分歧,通过协商达成一致。
1.4 统计学处理采用SPSS 26.0及MedCalc软件进行统计分析。符合正态分布的计量资料用t检验,非正态分布的资料用Mann-Whitney U检验。用Bland-Altman分析对各组的4个LV功能参数[EDV、ESV、EF和每搏输出量(SV)]进行自动与手动分析一致性检验。符合正态分布的变量采用Pearson检验,以相关系数(r2)评价变量之间的相关性;不符合正态分布的变量进行Spearman检验。
2 结果 2.1 人口学资料结果(表 1)显示:3组间年龄、身高、体质量两两比较差异均无统计学意义。
| 项目 | DCM组 (n=133) |
HCM组 (n=125) |
对照组 (n=135) |
| 年龄/岁 | 46±14 | 48±15 | 48±18 |
| 女性n(%) | 33(24.8) | 39(31.2) | 42(31.1) |
| 身高/cm | 169±8 | 168±8 | 169±8 |
| 体质量/kg | 70±15 | 70±12 | 67±13 |
结果(表 2)显示:DCM组LV自动分割错误率最高(24.8%)。图 1显示自动LV分割常见情况。
| 种类 | DCM组 (n=133) |
HCM组 (n=125) |
对照组 (n=135) |
| Ⅰ | 16 | 7 | 7 |
| Ⅱ | 10 | 7 | 9 |
| Ⅲ | 7 | 1 | 1 |
| 总计n(%) | 33(24.8) | 15(12.0) | 17(12.6) |
| Ⅰ: 左心室内膜和外膜识别错误;Ⅱ: 遗漏部分层面;Ⅲ: 未能准确识别收缩末期时相 | |||
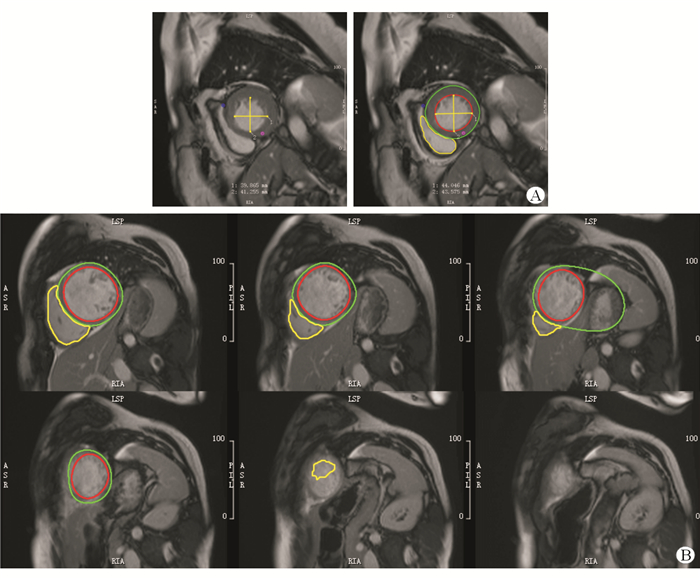
|
| 图 1 自动LV分割常见问题 A:ES时相,人工智能误判;B:从心脏基部到心尖部的所有ED时相图像,人工智能误将胃壁边缘作为心外膜边界,而心尖处由于信号差异不显著,人工智能未能识别心室. 红圈:心内膜边界;绿圈:心外膜边界;黄圈:未识别的右心室心内膜边界 |
结果(表 3)显示:HCM组EDV、ESV、EF和SV自动与手动分析结果差异均无统计学意义;DCM组ESV自动分析结果大于手动分析,SV和EF小于手动分析,差异均有统计学意义(P<0.01);对照组EF和SV自动分析结果大于手动分析,差异均有统计学意义(P<0.01)。
| 组别 | 舒张末期容积/mL | 收缩末期容积/mL | 射血分数/% | 每搏输出量/mL |
| DCM组 | ||||
| 手动 | 289.1±92.1 | 224.7±87.6 | 24.0±9.8 | 64.3±21.2 |
| 自动 | 291.1±93.0 | 234.2±89.7** | 21.0±9.5** | 56.9±22.0** |
| 差值 | 2.0±27.8 | 9.5±25.8 | -3.0±4.7 | -7.4±13.6 |
| HCM组 | ||||
| 手动 | 145.1±55.8 | 64.7±53.6 | 59.0±13.5 | 80.4±19.8 |
| 自动 | 146.1±55.4 | 63.8±52.2 | 59.3±12.7 | 81.4±20.6 |
| 差值 | 1.0±11.9 | -0.9±7.3 | 0.3±4.8 | 1.0±9.0 |
| 对照组 | ||||
| 手动 | 147.7±62.1 | 81.6±59.3 | 48.5±14.4 | 66.1±20.5 |
| 自动 | 149.1±63.1 | 80.3±60.7 | 50.2±15.0** | 69.0±20.9** |
| 差值 | 1.4±9.0 | -1.3±9.0 | 1.7±5.9 | 2.8±8.7 |
| DCM:扩张型心肌病;HCM:肥厚型心肌病. **P<0.01与手动分析结果相比 | ||||
结果(表 4)显示,与对照组相比,DCM组EDV和ESV手动和自动分析结果均增大(P<0.01),EF和SV手动和自动分析结果均减小(P<0.01)。与对照组相比,HCM组ESV手动和自动分析结果均减小(P=0.02),EF和SV手动和自动分析结果均增大(P<0.01),而EDV无明显变化。
| 组别 | 舒张末期容积/mL | 收缩末期容积/mL | 射血分数/% | 每搏输出量/mL |
| 手动分析 | ||||
| DCM组 | 289.1±92.1** | 224.7±87.6** | 24.0±9.8** | 64.3±21.2** |
| HCM组 | 145.1±55.8 | 64.7±53.6* | 59.0±13.5** | 80.4±19.8** |
| 对照组 | 147.6±62.0 | 81.5±59.4 | 48.6±14.4 | 66.1±20.5 |
| 自动分析 | ||||
| DCM组 | 291.1±93.0** | 234.2±89.7** | 21.0±9.5** | 56.9±22.0** |
| HCM组 | 146.1±55.4 | 63.8±52.2* | 59.3±12.7** | 81.4±20.6** |
| 对照组 | 149.1±63.1 | 80.3±60.7 | 50.2±15.0 | 69.0±20.9 |
| DCM:扩张型心肌病;HCM:肥厚型心肌病. *P<0.05,**P<0.01与对照组相比 | ||||
结果(图 2,表 5)显示:自动分析ESV诊断DCM、EF诊断HCM的曲线下面积(AUC)分别为0.935和0.695。ESV区分DCM患者的最佳截断值为111.3 mL,灵敏度和特异度为96.15%和85.19%。EF区分HCM患者的最佳截断值为53.8%,灵敏度为78.05%,特异度为54.07%。自动分析各LV参数对DCM诊断价值大于HCM。

|
| 图 2 LV各参数自动分析区分DCM(A)、HCM(B)的ROC分析 |
| 参数 | 截断值 | AUC (95% CI) | P值 | 灵敏度/% | 特异度/% |
| DCM | |||||
| 舒张末期容积 | >188.6 mL | 0.916(0.874~0.945) | <0.000 1 | 90.00 | 83.70 |
| 收缩末期容积 | >111.3 mL | 0.935(0.900~0.962) | <0.000 1 | 96.15 | 85.19 |
| 每搏输出量 | ≤61.0 mL | 0.672(0.627~0.742) | <0.000 1 | 62.31 | 67.41 |
| 射血分数 | ≤34.5% | 0.932(0.899~0.962) | <0.000 1 | 92.31 | 82.96 |
| HCM | |||||
| 舒张末期容积 | >112.0 mL | 0.502(0.445~0.570) | 0.958 8 | 82.93 | 28.15 |
| 收缩末期容积 | ≤63.9 mL | 0.619(0.550~0.673) | 0.000 7 | 76.42 | 47.41 |
| 每搏输出量 | >76.3 mL | 0.663(0.581~0.702) | <0.000 1 | 60.98 | 68.89 |
| 射血分数 | >53.8% | 0.695(0.620~0.737) | <0.000 1 | 78.05 | 54.07 |
结果(表 6,图 3A)显示:各组EDV与ESV自动分析结果均与手动分析结果高度相关(r2>0.9,P<0.01);DCM的4个参数自动与手动分析结果的相关性均最低;HCM与对照组EF和SV的自动与手动分析结果的相关性均较高。Bland-Altman分析(图 3B)显示:DCM的EDV和ESV被高估,EF和SV被低估。
| 参数 | r2值 | r值 | P值 |
| 舒张末期容积 | |||
| DCM组 | 0.912 | 0.955 | <0.01 |
| HCM组 | 0.954 | 0.977 | <0.01 |
| 对照组 | 0.980 | 0.990 | <0.01 |
| 收缩末期容积 | |||
| DCM组 | 0.918 | 0.958 | <0.01 |
| HCM组 | 0.982 | 0.991 | <0.01 |
| 对照组 | 0.978 | 0.989 | <0.01 |
| 射血分数 | |||
| DCM组 | 0.776 | 0.881 | <0.01 |
| HCM组 | 0.875 | 0.936 | <0.01 |
| 对照组 | 0.848 | 0.921 | <0.01 |
| 每搏输出量 | |||
| DCM组 | 0.646 | 0.803 | <0.01 |
| HCM组 | 0.812 | 0.901 | <0.01 |
| 对照组 | 0.831 | 0.912 | <0.01 |

|
| 图 3 LV功能参数的自动与手动相关性(A)和Bland-Altman一致性(B) |
CVI软件的CNN算法基于大量CMRI病例(包括HCM与DCM)的学习。本研究测量了CNN在健康人和HCM、DCM患者中的通用性,EDV、ESV和SV的自动与手动分析结果在HCM患者中的相关性与一致性最高,在DCM患者中最低,提示人工智能可靠性可能与心肌厚度相关。心室壁增厚有利于识别心内膜和心外膜,而DCM患者心腔扩大、室壁变薄,因此增大了识别难度[17]。
本研究中DCM的EF自动分析结果多分布在Bland-Altman图轴线上方。因此,在临床实践中,如果没有手动校正,DCM的EF结果会偏小,甚至为个位数,与相关研究[15-16]结果相符。因此,医师倾向于校正左心室心内膜边界,有意增加DCM患者EF,这可能是造成人工智能与手动分析间偏差的原因。而且,DCM患者心脏的横向重建常影响旋转力学,如心尖旋转和环向扭转减少,这可能导致ES和ED的错误定位,从而增加人工智能测量的误差[18]。
本研究中,人工智能从CMRI中获得的EDV、ESV和SV对DCM的诊断价值优于HCM。这可能是由于HCM的诊断主要由心肌厚度和EF决定,而不是由心室容积的变化决定,而DCM患者EF的显著下降常伴随心室容积的变化。本研究发现,对照组EF和SV手动和自动分析结果差异有统计学意义,其中CVI软件对二尖瓣层面的勾画失误可能为主要原因,进而使EF和SV的基线水平上移。但DCM组EF和SV的自动分析结果仍小于手动分析结果,进一步说明CVI低估DCM患者的病情程度。
2.2 CVI分析存在的问题及改进Liu等[18]首先确定了CVI在三维CMRI应变分析中的参考范围,进而发现心内膜的径向勾勒可能对平面特征缺失非常敏感,这是由于CVI软件沿着细微扭曲的心内膜边界进行勾勒。当二尖瓣环的原始节段部分丢失时,医师会模拟二尖瓣环的位置,以便进一步分析,但CVI软件常无法识别这类心肌丢失的层面,从而进一步导致评估错误[18]。
由于16段心肌在轴向、径向和环向上都有位移,而心尖和底部常难以扫描到。虽然扩大扫描范围和层面可以解决该问题,但同时增加患者反复屏气的负担。因此,操作者优化解剖定位或纠正错误非常重要,如纠正胃或心尖部的误判,或ES的错误识别。CMRI图像Cine序列被用于进行回顾性分析重建时,不同层面可能存在心动周期时相的细微差异,因此CVI软件在自动定位ES时需要微调。而靠近心尖部层面的心室腔缩小,加之肌小梁结构相对丰富,易被认作心外结构而被遗漏。此外,工程师可以针对心脏解剖的先验知识进一步改进CNN模型。但是,这2种解决方案都有缺点:前者会增加医生的负担并降低评估效率;而后者需要建立新的算法,即需要更新CNN算法本身。
目前的研究[19]已经证明,训练数据有限的CNN具有较低的通用性,而扩大训练数据集,包括来自不同数据源的足够数据是提高其通用性的简单方法。因此,增加深度学习数据库中各类心肌病患者的数量可以改进CNN对不同心肌病患者的诊断效能[20]。由于心脏运动的连续性,临床也可以通过对1个心动周期内所有Cine图像的追踪,使CVI分析对结果中突发的、不现实的心内膜运动自动报错,以此优化整个算法[21]。最新研究[22-23]提出新的分割心脏周期中LV内膜的方法,将来可以借鉴这些分割方法,提高分割结果的准确度。
本研究仍有一些局限性:(1)为回顾性研究,前瞻性临床应用仍有待评估;(2)为单中心试验,尚需多中心研究验证结论;(3)限制性心肌病、瓣膜性心肌病等其他心肌病未被纳入;(4)未分析心室壁解剖结构的判断错误及部分层面的遗漏与扫描前训练的相关性。
综上所述,本研究表明,对于不同心肌病,基于深度学习的CNN心功能分析可能具有不同的性能,在HCM中的表现优于DCM。尽管人工智能易低估DCM患者的心功能,但对EDV、ESV等的分析结果对诊断DCM较HCM更有帮助。在诊断HCM时,不能依赖人工智能分析。准确、高效的心功能分析是人工智能的主要优势,因此人工智能未来可以为心肌病的诊断提供更多有价值的信息。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
YANG X, SONG Q, SU Y. Automatic segmentation of left ventricle cavity from short-axis cardiac magnetic resonance images[J]. Med Biol Eng Comput, 2017, 55(9): 1563-1577.
[DOI]
|
| [2] |
AVENDI M R, KHERADVAR A, JAFARKHANI H. A combined deep-learning and deformable-model approach to fully automatic segmentation of the left ventricle in cardiac MRI[J]. Med Image Anal, 2016, 30: 108-119.
[DOI]
|
| [3] |
MARON M S, MARON B J. Clinical impact of contemporary cardiovascular magnetic resonance imaging in hypertrophic cardiomyopathy[J]. Circulation, 2015, 132(4): 292-298.
[DOI]
|
| [4] |
MARON B J, OMMEN S R, SEMSARIAN C, et al. Hypertrophic cardiomyopathy: present and future, with translation into contemporary cardiovascular medicine[J]. J Am Coll Cardiol, 2014, 64(1): 83-99.
[DOI]
|
| [5] |
KARIM R, BHAGIRATH P, CLAUS P, et al. Evaluation of state-of-the-art segmentation algorithms for left ventricle infarct from late Gadolinium enhancement MR images[J]. Medical image analysis, 2016, 30: 95-107.
[DOI]
|
| [6] |
MOCCIA S, MOCCIA S, BANALI R, et al. Development and testing of a deep learning-based strategy for scar segmentation on CMR-LGE images[J]. Magnetic Resonance Materials in Physics, Biology and Medicine, 2019, 32(2): 187-195.
[DOI]
|
| [7] |
ZHANG N, YANG G, GAO Z, et al. Deep learning for diagnosis of chronic myocardial infarction on nonenhanced cardiac Cine MRI[J]. Radiology, 2019, 291(3): 606-617.
[DOI]
|
| [8] |
WINTHER H B, HUNDT C, SCHMIDT B, et al. ν-Net: deep learning for generalized biventricular mass and function parameters using multicenter cardiac MRI data[J]. JACC Cardiovasc imaging, 2018, 11(7): 1036-1038.
[DOI]
|
| [9] |
MARON M S. Clinical utility of cardiovascular magnetic resonance in hypertrophic cardiomyopathy[J]. J Cardiovasc Magn Reson, 2012, 14(1): 13.
[DOI]
|
| [10] |
BONURA E D, BOS J M, ABDELSALAM M A, et al. Cardiac magnetic resonance imaging features in hypertrophic cardiomyopathy diagnosed at < 21 years of age[J]. Am J Cardiol, 2020, 125(8): 1249-1255.
[DOI]
|
| [11] |
NOURELDIN R A, LIU S, NACIF M S, et al. The diagnosis of hypertrophic cardiomyopathy by cardiovascular magnetic resonance[J]. J Cardiovasc Magn Reson, 2012, 14(1): 17.
[DOI]
|
| [12] |
SHE J Q, GUO J J, YU Y F, et al. Left ventricular outflow tract obstruction in hypertrophic cardiomyopathy: the utility of myocardial strain based on cardiac mr tissue tracking[J]. J Magn Reson Imaging, 2021, 53(1): 51-60.
[DOI]
|
| [13] |
CUI Y, CHEN Y, CAO Y, et al. Myocardial extracellular volume fraction measurements with MOLLI 5(3)3 by cardiovascular MRI for the discrimination of healthy volunteers from dilated and hypertrophic cardiomyopathy patients[J]. Clin Radiol, 2019, 74(9): 732.e9-732.e16.
[DOI]
|
| [14] |
MINEGISHI S, KATO S, TAKASE-MINEGISHI K, et al. Native T1 time and extracellular volume fraction in differentiation of normal myocardium from non-ischemic dilated and hypertrophic cardiomyopathy myocardium: a systematic review and meta-analysis[J]. Int J Cardiol Heart Vasc, 2019, 25: 100422.
|
| [15] |
TAO Q, YAN W, WANG Y, et al. Deep learning-based method for fully automatic quantification of left ventricle function from Cine MR images: a multivendor, multicenter study[J]. Radiology, 2019, 290(1): 81-88.
[DOI]
|
| [16] |
XU J, ZHUANG B Y, SIRAJUDDIN A, et al. MRI T1 mapping in hypertrophic cardiomyopathy: evaluation in patients without late gadolinium enhancement and hemodynamic obstruction[J]. Radiology, 2020, 294(2): 275-286.
[DOI]
|
| [17] |
VIGNEAULT D M, XIE W D, HO C Y, et al. Ω-Net (Omega-Net): fully automatic, multi-view cardiac MR detection, orientation, and segmentation with deep neural networks[J]. Med Image Anal, 2018, 48: 95-106.
[DOI]
|
| [18] |
LIU B Y, DARDEER A M, MOODY W E, et al. Reference ranges for three-dimensional feature tracking cardiac magnetic resonance: comparison with two-dimensional methodology and relevance of age and gender[J]. Int J Cardiovascular Imaging, 2018, 34(5): 761-775.
|
| [19] |
DREYER K J, GEIS J R. When machines think: radiology's next frontier[J]. Radiology, 2017, 285(3): 713-718.
[DOI]
|
| [20] |
QIAO M Y, WANG Y Y, GUO Y, et al. Temporally coherent cardiac motion tracking from cine MRI: Traditional registration method and modern CNN method[J]. Med Phys, 2020, 47(9): 4189-4198.
[DOI]
|
| [21] |
ZHAO S, GAO Z, ZHANG H, et al. Robust segmentation of intima-media borders with different morphologies and dynamics during the cardiac cycle[J]. IEEE J Biomed Health Inform, 2018, 22(5): 1571-1582.
[DOI]
|
| [22] |
DANGI S, LINTE C A, YANIV Z. A distance map regularized CNN for cardiac cine MR image segmentation[J]. Med Phys, 2019, 46(12): 5637-5651.
[DOI]
|
| [23] |
WU B, FANG Y, LAI X. Left ventricle automatic segmentation in cardiac MRI using a combined CNN and U-net approach[J]. Comput Med Imaging Graph, 2020, 82: 101719.
[DOI]
|
 2021, Vol. 28
2021, Vol. 28


