2012年起,欧美学者开始关注作为动物疾病治疗及生长促进剂用途的抗生素,可通过食物链富集进入人体内,对于一些特殊人群,比如孕产妇及其婴幼儿,可能会产生健康影响,特别是对新生儿肠道菌群定植过程可能产生影响[1-5]。此后,国内外学者针对人群食源性抗生素暴露的影响也进行了相关研究[6-11]。在此基础上,本研究以在首都医科大学附属北京妇产医院进行产检的孕晚期孕妇及其新生儿作为研究对象,通过对孕晚期孕妇血清、脐带血清及其新生儿胎便的食源性抗生素暴露情况进行分析,探讨生命体早期食源性抗生素暴露对新生儿肠道菌群的影响,为今后在围产领域进行相关防治工作提供参考。
1 资料与方法 1.1 一般资料选取2018年5月至12月于首都医科大学附属北京妇产医院产检的孕晚期(≥36周)孕妇及其新生儿,共计94例,其中样本收集完整病例共86例。纳入标准:规律产检的孕妇(≥36周)及其新生儿;同意本研究知情告知内容。排除标准:入组前2个月内接受过临床抗生素治疗。本研究经首都医科大学附属北京妇产医院伦理委员会批准(2018-KY-025-02),所有孕产妇均知情并签署知情同意书。
1.2 观察指标回顾性收集孕晚期孕妇临床资料,包括年龄、孕周、孕次、分娩方式、产时抗生素使用情况等。
1.3 分组依据新生儿的脐带血被认为是研究环境相关新生儿疾病较好的生物材料,可准确反映胎儿在宫内的化学物累积接触情况,相关数据可用于评估新生儿化学物暴露的健康风险。根据分娩后新生儿脐带血样本的抗生素暴露情况,将其分为对照组(n=43)和抗生素暴露组(n=43)。
1.4 检测样本(1) 母体血清样本取自孕晚期(孕36周及以上)孕妇静脉血;(2)脐带血清样本在新生儿断脐后15 min之内采集;(3)胎便样本在新生儿分娩之后48 h内采集。
1.5 检测方法采用超高效液相色谱-串联质谱(ultra-high performance liquid chromatography- mass spectrometry/mass spectrometry,UPLC-MS/MS)和时间分辨荧光免疫层析法(time resolved fluorescent immunochromatography assay,TRFIA)检测孕妇血清、脐带血清、胎便中β-内酰胺类、氟喹诺酮类、磺胺类、四环素类、酰胺醇类和林可酰胺类六大类抗生素(共计50种)的暴露情况。这些抗生素均在国内经济动物养殖过程中常用,包括32种兽用抗生素(veterinary antibiotics,VAs),9种兽用/临床通用抗生素(human/veterinary antibiotics,H/VAs)和9种临床用抗生素(human antibiotics,HAs)。通过16S rRNA二代测序分析新生儿肠道菌群结构。孕妇静脉血、脐带血及新生儿胎便样本的抗生素检测由上海溯源生物技术有限公司完成;新生儿胎便样本的肠道菌群检测由卡尤迪生物科技有限公司完成。
1.5.1 UPLC-MS/MS法UPLC-MS/MS采用Waters公司型号为ACQUITY UPLC® H-Class FTN,Xevo TQD的检测设备。抗生素标准物质采购自中国药品生物制品检定所。
取150 μL血清样本,加入150 μL的4%磷酸溶液,漩涡混匀1 min,取混合液200 μL加入到Oasis HLB μElution Plate小孔中进行固相萃取。上样前,SPE小孔依次用200 μL甲醇和200 μL水(2次,共400 μL水)活化平衡;上样后用100 μL水冲洗2次后再用抽滤装置抽干小孔。样本孔用50 μL、60%乙腈洗脱并抽滤2次至抽干;用96孔收集板收集2次洗脱液,上机待测。
1.5.2 液相条件色谱柱采用ACQUITY UPLC HSS T3(1.8 μm,2.1×100 mm,美国Waters公司);柱温40℃,进样量5 μL,样品室温度10℃。流动相A为0.1%甲酸水溶液,流动相B为甲醇;流速0.4 mL/min。
1.5.3 质谱条件采用电喷雾离子源正负离子(ESI+/ESI-)切换模式,多反应监测(MRM)方式采集分析,毛细管电压分别为3.0 kV+/2.5 kV-,离子源温度为150℃,脱溶剂气温度为550℃,脱溶剂气流速为1 000 L/h,锥孔气流速为50 L/h。
1.5.4 TRFIA法抗生素检测试剂盒均由上海溯源生物技术有限公司生产,配套使用上海溯源生物技术有限公司生产的SS-030型时间分辨荧光免疫分析仪,抗生素标准物质采购自中国药品生物制品检定所。
取150 μL稀释液加入样本杯,吸打混匀3~5次,再加入10 μL血清样本,吸打混匀3~5次,插入检测条,等待反应6 min,取出检测条,将其插入时间分辨荧光免疫分析仪中读数。
1.5.5 新生儿肠道菌群检测新生儿分娩之后48 h内采集新鲜胎便至特定样本采集管。由卡尤迪生物科技有限公司利用16S rRNA二代测序平台lllumina MiSeq对胎便进行检测及分析。分别对对照组和抗生素暴露组胎便进行肠道菌群α-多样性分析(包括丰度指数、香农指数、深度指数、物种信息指数)和多种属水平的比较。
1.6 统计学处理采用SPSS 22.0进行统计学分析。计数资料以n(%)表示,组间比较采用χ2检验;符合正态分布的计量资料以x±s表示,组间比较采用t检验。检验水准(α)为0.05。
2 结果 2.1 一般资料分析结果(表 1)显示:共完整收集86例孕晚期孕妇样本,年龄24~39岁,孕周36~41周。对照组和抗生素暴露组孕妇的年龄、孕周、孕次、分娩方式差异无统计学意义。
| 组别 | 年龄/岁 | 孕周 | 孕次 | 阴道分娩n(%) | 剖宫产n(%) |
| 对照组(n=43) | 30.4±4.0 | 36.8±4.0 | 2.8±1.7 | 28(65.1) | 15(34.9) |
| 暴露组(n=43) | 29.5±3.3 | 37.3±3.6 | 2.9±1.5 | 26(60.5) | 17(39.5) |
| t/χ2值 | 0.387 | 1.404 | 0.639 | 0.199 | 0.199 |
| P值 | 0.693 | 0.182 | 0.495 | 0.824 | 0.824 |
结果(表 2~4)显示:在排除临床用药后,2种检测方法(UPLC-MS/MS法和TRFIA法)均提示孕晚期孕妇血清、脐带血清、胎便样本中抗生素呈现高比例暴露,甚至包括孕期禁用、慎用药物,且在脐带血抗生素的暴露比例高于孕妇血清。
| n(%) | |||||||||||||||||||||||||||||
| 种类 | TRFIA(+) | UPLC-MS/MS(+) | |||||||||||||||||||||||||||
| 磺胺类 | 0(0) | 0(0) | |||||||||||||||||||||||||||
| 林可酰胺类 | 1(1.16) | 1(1.16) | |||||||||||||||||||||||||||
| 酰胺醇类 | 0(0) | 1(1.16) | |||||||||||||||||||||||||||
| β-内酰胺类 | 21(24.42) | 14(16.28) | |||||||||||||||||||||||||||
| 四环素类 | 0(0) | 0(0) | |||||||||||||||||||||||||||
| 氟喹诺酮类 | 9(10.47) | 3(3.49) | |||||||||||||||||||||||||||
| 任一抗生素暴露 | 29(33.72) | 18(20.93) | |||||||||||||||||||||||||||
| n(%) | |||||||||||||||||||||||||||||
| 种类 | TRFIA(+) | UPLC-MS/MS(+) | |||||||||||||||||||||||||||
| 磺胺类 | 0(0) | 0(0) | |||||||||||||||||||||||||||
| 林可酰胺类 | 1(1.16) | 1(1.16) | |||||||||||||||||||||||||||
| 酰胺醇类 | 1(1.16) | 2(2.33) | |||||||||||||||||||||||||||
| β-内酰胺类 | 32(37.21) | 21(24.42) | |||||||||||||||||||||||||||
| 四环素类 | 0(0) | 0(0) | |||||||||||||||||||||||||||
| 氟喹诺酮类 | 14(16.28) | 7(8.14) | |||||||||||||||||||||||||||
| 任一抗生素暴露 | 43(50.00) | 29(33.72) | |||||||||||||||||||||||||||
| n(%) | |||||||||||||||||||||||||||||
| 种类 | TRFIA(+) | UPLC-MS/MS(+) | |||||||||||||||||||||||||||
| 磺胺类 | 1(1.16) | 0(0) | |||||||||||||||||||||||||||
| 林可酰胺类 | 2(2.33) | 0(0) | |||||||||||||||||||||||||||
| 酰胺醇类 | 0(0) | 2(2.33) | |||||||||||||||||||||||||||
| β-内酰胺类 | 8(9.30) | 5(5.81) | |||||||||||||||||||||||||||
| 四环素类 | 3(3.49) | 2(2.33) | |||||||||||||||||||||||||||
| 氟喹诺酮类 | 0(0) | 0(0) | |||||||||||||||||||||||||||
| 任一抗生素暴露 | 11(12.79) | 7(8.14) | |||||||||||||||||||||||||||
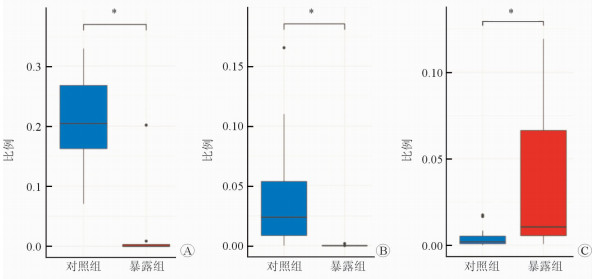
结果(图 1、图 2)显示,对照组和抗生素暴露组的新生儿肠道菌群差异有统计学意义(P<0.05)。抗生素暴露使出生后新生儿肠道菌群的α-多样性降低。抗生素暴露使原本属于优势菌群的粪杆菌属(Faecalibacterium)和瘤胃球菌属(Ruminococcus)数量显著减少,而链球菌属(Streptococcus)占据优势。

|
| 图 1 2组新生儿肠道菌群α-多样性分析 |
|
| 图 2 2组新生儿肠道菌群属水平差异 A:粪杆菌属;B:瘤胃球菌属;C:链球菌属. *P<0.05 |
19世纪70年代开始,随着抗生素制造工业的飞速发展,抗生素的应用拓展到了畜禽养殖领域。在动物养殖过程中,抗生素作为生长促进剂在加快动物生长和增产方面都起到了重要作用[12]。但由于抗生素应用时间的延长、应用范围的扩大及抗生素残留等多种因素,抗生素暴露对人群健康的影响引起研究者的广泛关注。联合国粮农组织/世界卫生组织(FAO/WHO)在20世纪90年代就基于细胞毒理学实验、动物实验、离体微生物实验以及人体研究证据对食源性抗生素进行评价并发布可接受的每日摄入量(acceptable daily intake,ADI)[13]。近阶段研究[14-17]结果提示,诸如抗生素残留等环境污染物的低剂量持续暴露也可能对于生命体早期生长发育产生影响。复旦公共卫生学院研究[18]发现,青少年儿童体内抗生素暴露已成为公共卫生问题,是促进其脂肪生成的重要因素之一。美国纽约大学医学院[1]通过一系列实验证实低剂量抗生素的持续性暴露干预了生命体早期的发育,部分抗生素的影响是终生的、不可逆的。Leclercq等[19]研究发现,抗生素甚至会对行为和脑神经化学造成长期影响。
本研究的研究对象来自首都医科大学附属北京妇产医院产科规律产检的孕晚期妊娠妇女,在排除临床用药后,孕晚期孕妇血清抗生素呈现高比例暴露,甚至包括孕期禁用、慎用药物,其来源推测以食物摄入为主。同一抗生素暴露在孕妇的不同样本中,可进入胎儿循环。而且脐带血中抗生素的暴露比例高于孕妇血清,可能与胎儿器官发育不完全,这些物质进入胎儿循环后无法代谢有关。
另外,学者们[20]发现食源性抗生素的低剂量、持续性暴露模式有别于临床抗生素药物的高剂量、短期暴露,而且食源性抗生素的这种低剂量、持续暴露模式更多是通过间接影响人体肠道菌群进而影响人体健康。已发表文献[1-4]亦指出,低剂量抗生素的持续暴露对于生命体早期人群(胎儿、婴幼儿)的影响主要是通过影响孕晚期孕妇肠道菌群结构,以及新生儿肠道菌群的定植,从而造成婴儿肠道菌群成熟延迟、代谢系统紊乱、免疫系统异常,导致其发生肥胖、过敏等。本研究显示,抗生素暴露组和对照组的新生儿肠道菌群存在显著差异。抗生素暴露使新生儿肠道菌群的α-多样性降低,且使原本属于优势菌群的粪杆菌属和瘤胃球菌属数量显著减少,而链球菌属占据优势。这一结果表明,食源性抗生素暴露对新生儿肠道菌群结构造成了影响。
综上所述,食源性抗生素可通过母体间接影响新生儿肠道菌群,进而影响婴幼儿健康。这一结论给临床提出了新的挑战,如何有效干预食源性抗生素暴露对生命体早期人群(胎儿、婴幼儿)的影响;进行孕晚期血清抗生素检测,筛查阳性暴露人群,并对该人群实施医疗干预(如饮食调整、益生菌的补充)是否可行,均需进一步深入研究。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
CHO I, YAMANISHI S, COX L, et al. Antibiotics in early life alter the murine colonic microbiome and adiposity[J]. Nature, 2012, 488(7413): 621-626.
[DOI]
|
| [2] |
COX L M, YAMANISHI S, SOHN J, et al. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences[J]. Cell, 2014, 158(4): 705-721.
[DOI]
|
| [3] |
BOKULICH N A, CHUNG J, BATTAGLIA T, et al. Antibiotics, birth mode, and diet shape microbiome maturation during early life[J]. Sci Transl Med, 2016, 8(343): 343ra82.
[DOI]
|
| [4] |
YOSHIMOTO A, UEBANSO T, NAKAHASHI M, et al. Effect of prenatal administration of low dose antibiotics on gut microbiota and body fat composition of newborn mice[J]. J Clin Biochem Nutr, 2018, 62(2): 155-160.
[DOI]
|
| [5] |
COX L M, BLASER M J. Antibiotics in early life and obesity[J]. Nat Rev Endocrinol, 2015, 11(3): 182-190.
[DOI]
|
| [6] |
WANG H, WANG B, ZHAO Q, et al. Antibiotic body burden of Chinese school children: a multisite biomonitoring-based study[J]. Environ Sci Technol, 2015, 49(8): 5070-5079.
[DOI]
|
| [7] |
WANG H, WANG N, WANG B, et al. Antibiotics in drinking water in Shanghai and their contribution to antibiotic exposure of school children[J]. Environ Sci Technol, 2016, 50(5): 2692-2699.
[DOI]
|
| [8] |
WANG H, WANG N, QIAN J, et al. Urinary antibiotics of pregnant women in Eastern China and cumulative health risk assessment[J]. Environ Sci Technol, 2017, 51(6): 3518-3525.
[DOI]
|
| [9] |
WANG H, YANG J, YU X, et al. Exposure of adults to antibiotics in a Shanghai suburban area and health risk assessment: a biomonitoring-based study[J]. Environ Sci Technol, 2018, 52(23): 13942-13950.
[DOI]
|
| [10] |
JI K, KHO Y, PARK C, et al. Influence of water and food consumption on inadvertent antibiotics intake among general population[J]. Environ Res, 2010, 110(7): 641-649.
[DOI]
|
| [11] |
LI N, HO K W K, YING G G, et al. Veterinary antibiotics in food, drinking water, and the urine of preschool children in Hong Kong[J]. Environ Int, 2017, 108: 246-252.
[DOI]
|
| [12] |
李凯年. 抗生素生长促进剂的历史、作用及发展趋势[J]. 畜牧兽医科技信息, 2005(10): 7-11. LI K N. The history, function and development trend of antibiotic growth promoters[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2005(10): 7-11. [CNKI] |
| [13] |
LU F C. Acceptable daily intake: inception, evolution, and application[J]. Regul Toxicol Pharmacol, 1988, 8(1): 45-60.
[DOI]
|
| [14] |
HU Q, LIU C, ZHANG D, et al. Effects of low-dose antibiotics on gut immunity and antibiotic resistomes in weaned piglets[J]. Front Immunol, 2020, 11: 903.
[DOI]
|
| [15] |
JIN S, ZHAO D, CAI C, et al. Low-dose penicillin exposure in early life decreases Th17 and the susceptibility to DSS colitis in mice through gut microbiota modification[J]. Sci Rep, 2017, 7: 43662.
[DOI]
|
| [16] |
DING C, YANG D, MA J, et al. Effects of free antibiotic resistance genes in the environment on intestinal microecology of mice[J]. Ecotoxicol Environ Saf, 2020, 204: 111119.
[DOI]
|
| [17] |
CHAMPAGNE-JORGENSEN K, MIAN MF, KAY S, et al. Prenatal low-dose penicillin results in long-term sex-specific changes to murine behaviour, immune regulation, and gut microbiota[J]. Brain Behav Immun, 2020, 84: 154-163.
|
| [18] |
WANG H, WANG N, WANG B, et al. Antibiotics detected in urines and adipogenesis in school children[J]. Environ Int, 2016, 89-90: 204-211.
[DOI]
|
| [19] |
LECLERCQ S, MIAN F M, STANISZ A M, et al. Low-dose penicillin in early life induces long-term changes in murine gut microbiota, brain cytokines and behavior[J]. Nat Commun, 2017, 8: 15062.
|
| [20] |
CERNIGLIA C E, KOTARSKI S. Approaches in the safety evaluations of veterinary antimicrobial agents in food to determine the effects on the human intestinal microflora[J]. J Vet Pharmacol Ther, 2005, 28(1): 3-20.
|
 2021, Vol. 28
2021, Vol. 28


