家族性男性性早熟(familial male-limited precocious puberty,FMPP)又称家族性高睾酮血症,为常染色体显性遗传,仅男性发病。FMPP系因黄体生成素/人绒毛膜促性腺激素受体(luteinizing hormone/choriogonadotropin receptor, LHCGR)基因突变引起LHCGR结构性激活, 是外周性性早熟[1]的一种罕见病因,不依赖于下丘脑-垂体-性腺轴激活。FMPP男孩性激素水平升高、第二性征发育、精子生成,临床表现为体格快速生长、性发育和骨骼成熟,在0~4岁进展快速.常伴有攻击性行为;阴茎增长明显,而睾丸容积与性发育水平不相称。2016年4月郑州儿童医院内分泌遗传代谢科病房收治1例2岁5个月FMPP患儿,经基因检测证实为LHCGR基因杂合突变c.1723A>C(NM_000 233.3)导致第575位氨基酸残基由异亮氨酸变为亮氨酸。现将该病例报告如下。
1 资料与方法 1.1 一般资料患儿男性,2岁5个月,以“发现阴茎增粗增大1年11个月”为代主诉于2016年4月入我院。患儿出生时阴茎大小正常;半岁后即发现患儿阴茎比同龄儿大,未在意;近半年阴茎增大明显,且每日勃起数次,伴生长加速,有攻击性行为。患儿血尿粪常规均正常;肝肾功、心肌酶、电解质正常;甲胎蛋白、糖类抗原(CA)-125、癌胚抗原正常。父亲及其他家族成员无类似病史。
1.2 基因检测在其父母签署基因检测知情同意书的情况下,采集患儿及父母的外周静脉血各2 mL于乙二胺四乙酸(EDTA)抗凝管中,对患儿及其父母外周血白细胞LHCGR基因的第11个外显子编码区直接测序,进行致病突变分析。
1.3 基因致病性分析应用在线软件PolyPhen-2(http://genetics.bwh.harvard.edu/pph2/)和MutationTaster(http://mutationtaster.org/MutationTaster/index.html)预测LHCGR基因变异的致病性,根据美国医学遗传学与基因组学学会(The American College of Medical Genetics and Genomics,ACMG)遗传变异分类标准与指南[2]进行评级。
1.4 治疗方法在患儿家长签署知情同意书后,予以雄激素受体拮抗剂螺内酯(20 mg/次,2次/d)联合芳香化酶抑制剂来曲唑(1.25 mg/次,1次/d)口服,出现中枢性性早熟时加用促性腺激素释放激素激动剂(GnRHa)治疗。
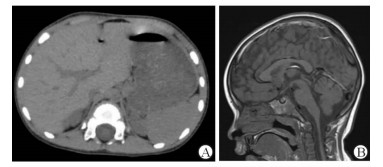
2 结果 2.1 患儿性征及血生化检查结果患儿身高98 cm(同年龄同性别儿童的第75~90百分位),体质量15 kg,双侧睾丸3.5 mL,阴茎长7 cm、横径2 cm,阴毛PH2期。结果(表 1)显示:患儿人绒毛膜促性腺激素正常,17α-羟孕酮、雄烯二酮、硫酸脱氢表雄酮均正常,血清睾酮升高明显,而促性腺激素释放激素(GnRH)激发试验中LH峰值、卵泡刺激素(FSH)峰值均不高。患儿骨龄相当于4岁,睾丸彩超、肾上腺CT、垂体MRI检查均未发现异常(图 1)。
| 项目 | 检测值 | 参考值 |
| 黄体生成素zB/(mU·mL-1) | ||
| 基础值 | < 0.1 | - |
| GnRH激发峰值 | 0.88 | - |
| 卵泡刺激素zB/(mU·mL-1) | ||
| 基础值 | 0.2 | - |
| GnRH激发峰值 | 1.35 | - |
| 睾酮ρB/(ng·mL-1) | 3.09 | < 0.025 |
| 雌二醇ρB/(pg·mL-1) | < 5 | < 5 |
| 雄烯二酮ρB/(ng·mL-1) | 0.18 | 0.5~4.8 |
| 硫酸脱氢表雄酮ρB/(μg·dL-1) | 10.90 | 0.47~19.4 |
| 孕酮ρB/(ng·mL-1) | <0.03 | 0.2~1.4 |
| 17α-羟孕酮ρB/(ng·mL-1) | 0.719 | 0~40 |
| 人绒毛膜促性腺激素zB/(mU·mL-1) | < 0.1 | 0~5 |
| 促甲状腺激素zB/(mU·L-1) | 2.790 | 0.7~5.97 |
| 总三碘甲腺原氨酸cB/ (nmol·L-1) | 2.71 | 1.42~3.8 |
| 总甲状腺素cB/(nmol·L-1) | 109.0 | 76.6~189 |
| 促肾上腺皮质激素ρB/(pg·mL-1) | 16.91 | 6~40 |
| 皮质醇ρB/(ng·mL-1) | 69.469 | 72.6~322.8 |
| 胰岛素样生长因子-1 ρB/(ng·mL-1) | 295.926 | 45~850 |
| GnRH:促性腺激素释放激素 | ||
|
| 图 1 患儿肾上腺CT及垂体MRI检查 A:肾上腺CT检查示,双侧肾上腺形态、大小可,未见异常回声;B:垂体MRI示,垂体高5.1 mm,未见异常信号 |
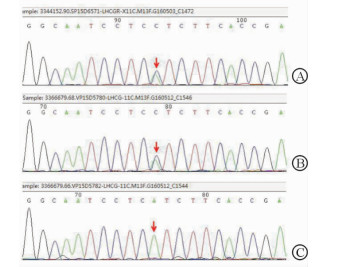
患儿及母亲LHCGR基因第11外显子1723A>C突变(图 2),患儿母亲未出现青春发育异常。该突变导致第575位氨基酸残基由异亮氨酸变为亮氨酸。LHCGR蛋白p.I575L突变,经Mutation Taster软件预测为致病性突变,准确性0.999;经PolyPhen-2软件预测亦为致病性突变,准确性0.986(灵敏度0.54、特异性0.94)。ACMG评级为:强(PS1)+中等(PM1+PM2)+支持证据(PP3+PP4),最终评为致病性的。
|
| 图 2 LHCGR基因测序结果 A:受检者LHCGR基因c.1723A>C杂合突变;B:受检者之母LHCGR基因c.1723A>C杂合突变;C:受检者之父LHCGR基因c.1723位点未见异常 |
截至2019年4月共随访3年,患儿身高增加30 cm,骨龄增加3岁,阴茎未再继续增大,睾丸容积增加至6 mL,阴茎勃起次数减少,攻击性行为减少,未出现乳房发育及痤疮,血压、电解质无异常。
3 讨论 3.1 FMPP及基因特点FMPP是外周性性早熟罕见的病因,属常染色体显性遗传,仅男性发病。正常情况下,LH与睾丸Leydig细胞上的LH受体结合,激活腺苷酸环化酶,促使睾酮的合成增加。FMPP患儿LH受体不需与LH结合,而呈持续性激活,导致细胞内非LH依赖性的cAMP增加,Leydig细胞持续分泌睾酮。
人类的LH受体蛋白属于G蛋白偶联受体家族成员,共由674个氨基酸残基组成蛋白分子骨架,分为细胞外N端结构域、7个跨膜螺旋区和细胞内C端结构域。LH受体可同时与LH、HCG结合,因此也被称为LH/CG受体,编码基因为LHCGR。LHCGR基因位于2p21,约80 kb,包括10个内含子和11个外显子。目前国内外所报道的基因突变均位于第11外显子,其1 624~1 741是热点突变区。该热点突变区常位于LHCGR第6跨膜螺旋,编码第571~581位氨基酸。研究发现,LHCGR基因的突变可以是激活性的(引起男性FMPP),也可以是失活性的(引起男性性分化障碍或女性无排卵)。目前国内外报道的LHCGR激活性基因突变共有19种,其中最常见的突变是第6跨膜区第578位的天冬氨酸被甘氨酸代替(D578G)。此突变在美国FMPP患者中约占90%[3]。
LHCGR基因第11外显子1723A>C突变由Laue [4]在1996年首次在1例非裔美国FMPP患儿中发现。该研究证实,在无激动剂存在的情况下,腺苷酸环化酶的合成显著增加,提示睾丸Leydig细胞的自发活性来源于LH受体的自发性持续性激活,证实该突变为引起该病的致病性突变,但这种突变在国内未见报道。国内茅江峰等[5]于2010年首次报道了LHCGR基因杂合突变(M398T)导致FMPP中国人家系,且发现汉族人群LHCGR基因可能存在多态性。陈瑞敏等[6]报道1例Ala568Val杂合突变;王敏[7]报道1例Asp578His杂合突变所致的FMPP。
3.2 本病例患儿性征及基因特点本患儿2岁5个月,有典型的FMPP临床表现,阴茎增粗增大,长7 cm,横径2 cm,且出现阴毛,血清睾酮升高明显,骨龄超前,而促性腺激素释放激素激发试验中LH峰值、FSH峰值均不高,不支持中枢性性早熟;结合孕酮、血17α-羟孕酮、雄烯二酮、硫酸脱氢表雄酮、促肾上腺皮质激素、皮质醇均正常,不支持先天性肾上腺皮质增生症;肾上腺CT、睾丸彩超、垂体MRI无异常,可排除肾上腺肿瘤、睾丸肿瘤及垂体肿瘤等;全身皮肤未见咖啡斑,不支持Mccune-Albright综合征,最后通过基因分析,确定为LHCGR基因第11外显子1723A>C突变,导致第575位氨基酸残基由异亮氨酸变为亮氨酸,诊断为FMPP。1983年,Rosenthal等[8]率先描述了FMPP的临床特征:性早熟、高睾酮、低LH水平,其性激素升高不依赖于下丘脑-垂体-性腺轴激活,临床表现为外周性性早熟。
3.3 FMPP治疗FMPP患儿由于骨龄超前,导致终身高矮小[9],且治疗困难。Alemida等[10]随访了10例达到终身高的FMPP患儿,其中5例应用醋酸环丙孕酮、5例应用酮康唑,认为长期使用醋酸环丙孕酮与酮康唑治疗效果类似,无严重的不良反应,然而,这2种药物对身高的作用有限。Soriano-Guillén等[11]随访了5例应用酮康唑的患儿,其睾酮水平下降,终身高与靶身高一致,且显著高于治疗前预测的身高。有研究[12]称螺内酯、睾内酯联合GnRHa可提高青春期前的生长速率和促性腺激素水平,但对终身高改善不明显。而近年来采用比卡鲁胺联合阿那曲唑治疗FMPP较多。比卡鲁胺作为非甾体类的雄激素受体拮抗剂,可用来治疗前列腺癌[13]。其可以与雄激素受体结合,促进雄激素受体降解。Yoshizama-Ogasawara[14]等首次报道,联合应用第3代芳香化酶抑制剂阿那曲唑和螺内酯可有效抑制骨龄进展、延长青春期阶段,从而增加终身高。Kor[15]报道1例联合使用比卡鲁胺、阿那曲唑和醋酸曲普瑞林治疗3年的患儿,其每年身高增加5 cm,骨龄增长2年后骨龄/生理年龄比值(BA/CA)降低1.73~1.42,且没有出现药物相关不良反应。比卡鲁胺和阿那曲唑治疗FMPP的国际多中心研究[16]中,13例患儿治疗12个月,其中9例生长速率降低,但差异无统计学意义;BA/CA明显降低,从2.1±0.6降至1.0±0.4;阴毛Tanner分期多保持不变,平均睾丸体积稍增加;50%的患者乳腺发育,12.5%发生乳腺疼痛。
本患儿入院初用螺内酯治疗6个月后,家长自觉效果不明显,且患儿有尿频症状,要求停药观察;观察1年后,因身高增长快速,复测骨龄进展明显,在患儿家长签署知情同意书后,应用来曲唑联合螺内酯治疗;7个月后出现中枢性性早熟,予以加用GnRHa治疗,骨龄进展缓慢。至2019年4月共随访3年,身高增加30 cm,骨龄增加3岁,阴茎未再继续增大,睾丸容积增加至6 mL,阴茎勃起次数减少,攻击性行为改善,睾酮水平下降,未出现乳房发育及痤疮,血压、电解质均正常,继续进行随访。
3.4 患儿母亲基因特点及表现该患儿母亲具有同样的基因突变,但并未出现性早熟表现,可能是因为女性卵泡发育和雌激素产生需要同时有LH和FSH参与,单独激活LH受体尚不足以使卵泡发育并产生大量雌激素,其次与青春期前女性性腺上不表达或低表达LHCGR有关。
综上所述,本研究通过基因分析发现LHCGR基因第11外显子1723A>C突变(p.Ile575Leu)的非LH依赖的FMPP。患儿母亲虽然存在相同的杂合突变,但并无异常临床表现。本研究结果提示,对于男性外周性性早熟患者,要考虑到FMPP可能。
| [1] |
颜纯, 王慕逖. 小儿内分泌学[M]. 北京: 人民卫生出版社, 2006: 325-328.
|
| [2] |
王秋菊, 沈亦平, 邬玲仟, 等. 遗传变异分类标准与指南[J]. 中国科学:生命科学, 2017, 47(6): 668-688. [URI]
|
| [3] |
LAUE L, CHAN W Y, HSUEH A J, et al. Genetic heterogeneity of constitutively activating mutation of the human luteinizing hormone receptor in familial male-limited precocious puberty[J]. Pro Natl Acad Sci USA, 1995, 92(6): 1906-1910.
[DOI]
|
| [4] |
LAUE L, WU S M, KUDO M, et al. Heterogeneity of activating mutations of the human luteinizing hormone receptor in male-limited precocious puberty[J]. Biochem Mol Med, 1996, 58(2): 192-198.
[URI]
|
| [5] |
茅江峰, 伍学焱, 聂敏, 等. 生殖细胞系黄体生成素受体基因杂合突变(M398T)导致家族性男性性早熟[J]. 中华内科杂志, 2010, 49(12): 1024-1027. [DOI]
|
| [6] |
陈瑞敏, 张莹, 杨晓红, 等. 家族性男性性早熟一家系LHCGR基因突变分析[J]. 中华医学遗传学杂志, 2012, 29(6): 631-634. [DOI]
|
| [7] |
王敏, 李敏, 刘悦笙, 等. LHCGR基因突变(Asp578His)致家族性男性性早熟1例临床特点及基因分析[J]. 中国当代儿科杂志, 2017, 19(11): 1159-1164. [DOI]
|
| [8] |
ROSENTHAL S M, GRUMBACH M M, KAPLAN S L. Gonadotropin-independent familial sexual precocity with premature Leydig and germinal cell maturation(familial testotoxicosis):effects of a potent luteinizing hormone-releasing factor agonist and medroxyprogesterone acetate therapy in four cases[J]. J Clin Endocrinol Metab, 1983, 57(3): 571-579.
[DOI]
|
| [9] |
EUGSTER E A. Peripheral precocious pubety:causes and current management[J]. Horm Res, 2009, 71(Suppl 1): 64-67.
[URI]
|
| [10] |
ALMEIDA M Q, BRITO V N, LINS T S, et al. Long-term treatment of familial male-limited precocious puberty (testotoxicosis) with cyproterone acetate or ketoconazole[J]. Clin Endocrinol (Oxf), 2008, 69(1): 93-98.
[DOI]
|
| [11] |
SORIANO-GUILLÉN L, LAHLOU N, CHAUVET G, et al. Adult height after ketoconazole treatment in patients with familial male-limited precocious puberty[J]. J Clin Endocrinol Metab, 2005, 90(1): 147-151.
[DOI]
|
| [12] |
LAUE L, JONES J, BARNES K M, et al. Treatment of familial male precocious puberty with spironolactone, testolactone, and deslorelin[J]. J Clin Endocrinol Metab, 1993, 76(1): 151-155.
[URI]
|
| [13] |
FURR B J. The development of Casodex (bicalutamide):preclinical studies[J]. Eur Urol, 1996, 29(Suppl 2): 83-95.
[URI]
|
| [14] |
YOSHIZAWA-OGASAWARA A, KATSUMATA N, HORIKAWA R, et al. Third-generation aromatase inhibitor improved adult height in a Japanese boy with testotoxicosis[J]. Clin Pediatr Endocrinol, 2014, 23(2): 53-58.
[URI]
|
| [15] |
KOR Y. Central precocious puberty in a case of late-diagnosed familial testotoxicosis and long-term treatment monitoring[J]. Hormones (Athens), 2018, 17(2): 275-278.
[DOI]
|
| [16] |
REITER E O, MAURAS N, MCCORMICK K, et al. Bicalutamide plus anastrozole for the treatment of gonadotropin-independent precocious puberty in boys with testotoxicosis:a phase Ⅱ, open-label pilot study (BATT)[J]. J Pediatr Endocrinol Metab, 2010, 23(10): 999-1009.
[PubMed]
|
 2020, Vol. 27
2020, Vol. 27


