2. 上海中医药大学附属曙光医院肾病科,上海 201200
2. Department of Nephrology, Shuguang Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 201200, China
急性肾损伤(acute kidney injury, AKI)是一组由多因素导致的、以肾功能急速下降为主要特征的临床综合征[1]。脓毒症是AKI最常见的诱发因素[2],脓毒症相关急性肾损伤(sepsis associated acute kidney injury, S-AKI)是脓毒症患者的常见并发症。在重症监护室(intensive care unit, ICU)中,超过50%的AKI患者符合S-AKI诊断[3],相关死亡率高达60%[4]。S-AKI发病机制复杂,既往研究提示炎症微环境、血流动力学等多种因素参与其中,缺乏有效的防治方法[5]。鉴于S-AKI高住院率和高死亡率引发的社会负担,探索新的S-AKI治疗靶点很有必要[6]。
铁死亡(ferroptosis)是一种新发现的调控性细胞死亡方式,以铁介导的脂质过氧化过度累积为特征,最终导致细胞发生不可逆性氧化损伤[7],其中铁离子具有不可替代性[8]。近年来,铁死亡在多种急慢性肾脏病中的作用受到重视,如叶酸诱导的急性肾损伤(folic acid-induced AKI, FA-AKI)、糖尿病肾病(diabetic nephropathy, DN)、常染色体显性多囊肾病(autosomal dominant polycystic kidney disease, ADPKD)等[9-11]。膜铁转运蛋白(ferroportin, FPN)作为唯一介导铁离子出胞的膜转运蛋白,在机体铁代谢过程中具有重要作用[12]。同时,在神经退行性疾病动物模型中发现,FPN的减少可以促进胞内不稳定铁池(labile iron pool, LIP)富集[13]。目前,关于S-AKI过程中是否存在铁死亡及FPN是否参与介导铁死亡过程的报道较少,本研究旨在通过体内体外实验探讨FPN在LPS诱导的S-AKI铁死亡中的作用及铁死亡抑制剂调控的相关机制。
1 材料与方法 1.1 实验动物和主要试剂采用6~8周龄的C57BL/6雄性小鼠,体质量20~25 g,购自斯贝福(北京)生物技术有限公司。所有小鼠均在SPF级动物房内饲养。DMEM/F12培养基、Opti-MEM无血清培养基和胎牛血清购自Gibco公司。脂多糖(lipopolysaccharide, LPS)购自Sigma-Aldrich公司,反转录试剂和实时荧光定量PCR试剂购自南京诺唯赞生物科技股份有限公司,铁死亡抑制剂Ferrostatin-1(Fer-1)和去铁胺(Deferoxamine,DFO)、坏死性凋亡抑制剂Necrostatin-1(Nec-1)以及凋亡抑制剂Z-VAD(OH)-FMK(Z-VAD-FMK)购自MedChemExpress公司,FPN抗体购自Novus Biologicals公司,谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)抗体购自Abcam公司,信号转导和转录激活因子3(signal transducer and activator of transcription 3, STAT3)和P-STAT3抗体购自Cell Signaling Technology公司,β-actin抗体购自Sigma-Aldrich公司,转染试剂RNAiMAX购自Invitrogen公司,血清肌酐检测试剂盒购自南京建成生物工程研究所有限公司,尿素氮试剂盒和亚铁离子(Fe2+)比色法试剂盒购自武汉伊莱瑞特生物科技股份有限公司,脂质过氧化试剂盒购自碧云天生物技术有限公司,CCK-8试剂盒和FerroOrange探针购自Dojindo公司,C11 BODIPY 581/591荧光探针购自ThermoFisher Scientific公司。本研究所用siRNA由吉满生物科技有限公司合成,所用引物由生工生物工程股份有限公司合成。
1.2 实验方法 1.2.1 动物模型和实验分组小鼠随机分为4组:对照组、LPS组、LPS+Fer-1组、LPS+DFO组,每组3只小鼠。LPS组腹腔注射LPS 15 mg/kg,LPS+Fer-1组和LPS+DFO组分别在LPS注射前30 min腹腔注射Fer-1 5 mg/kg和DFO 100 mg/kg,铁死亡抑制剂体内实验浓度基于相关文献[9, 14]报道。戊巴比妥腹腔注射麻醉后对小鼠行心脏灌注,取肾脏组织进行后续实验。
1.2.2 细胞培养和处理人肾小管上皮细胞系HK-2细胞株购自美国模式培养集存库(American type culture collection,ATCC),仁济医院肾脏科实验室保存。HK-2于37 ℃、5% CO2培养箱中,用含有10% FBS的DMEM/F12培养基进行培养。当细胞扩增至约80%时,随机分为4组:对照组、LPS组、LPS+Fer-1组和LPS+DFO组。LPS组细胞加入100 μg/mL LPS培养24 h,LPS+Fer-1组和LPS+DFO组在加入LPS同时分别加入1 μmol/LFer-1和100 μmol/L DFO于培养基中培养24 h,细胞实验药物浓度基于文献[7]报道。
1.2.3 免疫组化染色将肾组织石蜡切片脱蜡至水,高压抗原修复,3% H2O2溶液15 min封闭内源性过氧化物酶,正常山羊血清室温封闭30 min后加入FPN一抗(1∶200)4 ℃孵育过夜,次日二抗室温摇床孵育1 h,充分洗涤后DAB显色,苏木精复染胞核,自来水返蓝,脱水、透明、封片,光镜下观察FPN表达变化情况。
1.2.4 Western印迹法提取小鼠肾脏和HK-2细胞蛋白后,10% SDS-PAGE电泳,250 mA湿转1 h,封闭后加入一抗(1∶1 000)4 ℃孵育过夜;β-actin抗体用作内参(1∶3 000)。次日TBST洗膜3遍,每次5 min,二抗室温摇床孵育1 h后,TBST洗膜3遍,每次5 min,ECL发光显影。
1.2.5 qRT-PCR检测根据说明书使用RNeasy试剂盒(Qiagen)提取小鼠肾组织或HK-2细胞RNA,以1 000 ng体系按照HiScript® Ⅲ RT SuperMix试剂盒说明,将RNA反转录为cDNA,再使用ChamQ SYBR Color qPCR Master Mix进行PCR反应。β-actin用作内参。引物序列详见表 1。
| 基因名称 | 方向 | 基因序列 |
| 人-β-actin | F | ACCTTCTACAATGAGCTGCG |
| 人-β-actin | R | CCTGGATAGCAACGTACATGG |
| 人-FPN | F | GGGTGGACAAGAATGCTAGAC |
| 人-FPN | R | ATGGTACATGGTCAGAAGCTC |
| 人-IL-6 | F | GGTACATCCTCGACGGCATCT |
| 人-IL-6 | R | GTGCCTCTTTGCTGCTTTCAC |
| 人-HAMP | F | TGTTTTCCCACAACAGACGGG |
| 人-HAMP | R | CGCAGCAGAAAATGCAGATGG |
| 小鼠-β-actin | F | AAGAGCTATGAGCTGCCTGA |
| 小鼠-β-actin | R | TACGGATGTCAACGTCACAC |
| 小鼠-FPN | F | TCTCTGTGATTGTGACCGTG |
| 小鼠-FPN | R | AATTTCCTTGCCCGTAGAGTC |
| 小鼠-IL-6 | F | CTCCCAACAGAGACCTGTCTATAC |
| 小鼠-IL-6 | R | CCATTGCACAACTCTTTTCTCA |
| 小鼠-Hamp | F | GCCTGTCTCCTGCTTCTGCT |
| 小鼠-Hamp | R | GCTCTGTAGTCTGTCTCATCTGTT |
将HK-2细胞接种至96孔板,分别加入LPS与铁死亡抑制剂Fer-1或DFO、坏死性凋亡抑制剂Nec-1、凋亡抑制剂Z-VAD-FMK进行干预,培养24 h后吸出药液,按照CCK-8试剂盒说明书每孔加入10 μL CCK-8工作液和90 μL DMEM/F12,37 ℃培养2 h后用酶标仪检测细胞活力。
1.2.7 siRNA沉默FPN将HK-2细胞接种至12孔板,待细胞铺板密度扩增至约60%时,吸出培养基,将siRNA和RNAiMAX分别加入Opti-MEM中并吹打混匀,然后将siRNA加入RNAiMAX中,静置5 min后加入细胞培养板,培养箱放置48 h后进行后续实验检测。
1.2.8 其他检测根据血肌酐、尿素氮试剂盒说明书进行相应检测。使用脂质氧化检测试剂盒检测小鼠肾组织中脂质过氧化标志物丙二醛(malondialdehyde, MDA)含量,使用C11 BODIPY581/591探针荧光显微镜下观察细胞脂质过氧化状况。使用亚铁离子比色法试剂盒检测肾组织中亚铁离子含量,使用FerroOrange荧光探针观察细胞LIP变化。小鼠处死后1 min内,取肾脏并用手术刀片切取约1 mm3肾组织,保存于2.5%戊二醛固定液中,固定24 h后送检,使用透射电镜观察肾小管上皮细胞线粒体形态。
1.3 统计学处理采用GraphPad Prism软件对数据进行统计分析,满足正态分布及方差齐性的计量资料以x±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验。检验水准(α)为0.05。
2 结果 2.1 铁死亡是LPS诱导脓毒症微环境中的重要细胞死亡方式结果(图 1A)显示:与对照组相比,LPS组HK-2细胞活力显著降低(P<0.01),LPS+Fer-1组和LPS+DFO组HK-2细胞活力显著高于LPS组(P<0.01),提示铁死亡抑制剂有效缓解LPS刺激诱导的细胞活力降低。坏死性凋亡抑制剂Nec-1与Z-VAD-FMK干预后的HK-2细胞活力与LPS组差异无统计学意义(P>0.05),提示铁死亡参与LPS刺激诱导HK-2细胞损伤。LIP以及脂质过氧化的检测结果(图 1B、图 1C)显示:LPS刺激促进了细胞LIP的增加与脂质过氧化,而铁死亡抑制剂有效缓解了铁死亡表型。

|
| 图 1 铁死亡是LPS诱导脓毒症微环境中的HK-2细胞重要死亡方式 A:HK-2细胞活力;B:FerroOrange检测HK-2细胞质内LIP,红色荧光强度表示细胞内LIP含量;C:C11 BODIPY 581/591检测脂质过氧化,绿色荧光表示探针氧化态信号,红色荧光为非氧化态信号。**P<0.01与对照组相比,△△P<0.01与LPS组相比。 |
血清检测结果(图 2A、图 2B)显示:小鼠血清肌酐和尿素氮水平,LPS组显著高于对照组(P<0.01),肾功能受损表现符合AKI诊断;LPS+Fer-1组与LPS+DFO组显著低于LPS组(P<0.01)。肾组织匀浆检测结果(图 2C、图 2D)显示:LPS组小鼠肾组织中MDA和LIP亚铁离子含量较对照组显著升高(P<0.01)。电镜检测观察超微结构(图 2E)显示:LPS组小鼠肾小管上皮细胞线粒体嵴断裂明显,双层膜密度增加,符合铁死亡形态学特征。PAS染色(图 2F)可见LPS组小鼠肾小管内空泡增多,肾小管管腔扩张,刷状缘脱落,提示肾脏病理损伤加重,而LPS+Fer-1组与LPS+DFO组小鼠肾小管上皮细胞脱落减少,刷状缘脱落减少,提示铁死亡抑制剂的干预缓解了LPS诱导的肾脏病理损伤。Western印迹法结果(图 2G)显示:与对照组相比,LPS组铁死亡标志物GPX4表达显著下降;LPS+Fer-1组与LPS+DFO组GPX4表达明显高于LPS组(P<0.01)。
|
| 图 2 抑制铁死亡有效缓解S-AKI A:小鼠血清肌酐水平;B:小鼠血清尿素氮水平;C:肾脏丙二醛含量;D:肾脏不稳定铁池(Fe2+)含量;E:电镜观察肾小管上皮细胞线粒体形态;F:肾脏PAS染色(Original magnification:×400),红色箭头示肾小管上皮细胞核脱落,黄色箭头示肾小管刷状缘丢失;G:Western印迹法检测小鼠肾脏GPX4表达。*P<0.05与对照组相比,**P<0.01与对照组相比,△△P<0.01与LPS组相比。 |
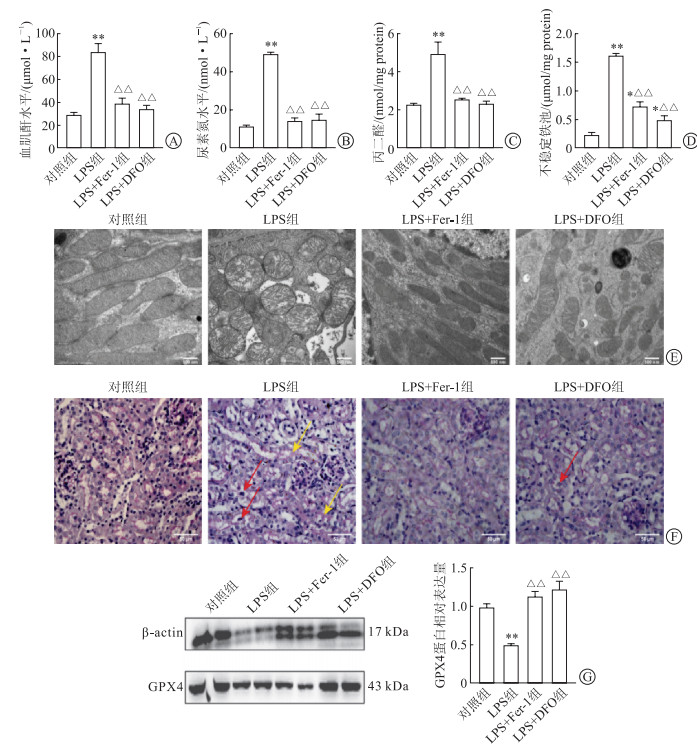
Western印迹法结果(图 3A、图 3B)显示:在体内体外模型中,与对照组相比,LPS处理后小鼠肾脏FPN表达均明显下降(P<0.01)。肾组织免疫组化染色(图 3C)显示:FPN主要于肾小管上皮细胞胞膜表达,LPS组表达量显著减少。
|
| 图 3 LPS显著抑制FPN表达 A:Western印迹法检测小鼠肾组织FPN体内表达;B:Western印迹法检测HK-2细胞FPN蛋白表达;C:小鼠肾组织FPN免疫组化染色, Original magnification:×200。**P<0.01。 |
siRNA沉默HK-2细胞FPN后使用Western印迹法进行验证,结果(图 4A)显示,siRNA有效抑制了HK-2细胞中FPN的表达。使用FerroOrange和C11 BODIPY 581/591荧光探针检测细胞LIP与脂质过氧化,结果(图 4B、图 4C)显示:沉默FPN的HK-2细胞LIP和脂质过氧化水平显著升高,铁死亡表征增加,提示FPN减少参与铁死亡反应过程。

|
| 图 4 siRNA沉默FPN诱导铁死亡表征 A:Western印迹法验证siRNA干扰效果;B:FerroOrange检测HK-2细胞LIP,红色荧光强度表示细胞内LIP含量;C:C11 BODIPY 581/591检测HK-2细胞脂质过氧化,绿色荧光表示探针氧化态信号,红色荧光为非氧化态信号。 |
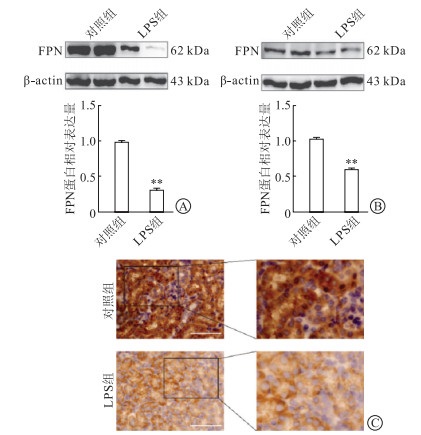
铁调素(hepcidin)是一种内源性抗菌多肽,参与机体铁调控,可以与FPN结合促进其内化降解。使用qRT-PCR检测铁调素mRNA(HAMP),体内、体外模型结果(图 5)显示:与对照组相比,LPS组HAMP表达均有显著升高。
|
| 图 5 FPN下调与铁调素升高相关 A:体内实验铁调素mRNA水平;B:体外实验铁调素mRNA水平。**P<0.01。 |
利用Western印迹法检测HAMP上游启动子STAT3,发现LPS组较对照组STAT3激活形式磷酸化蛋白P-STAT3显著激活,铁死亡抑制剂可抑制该通路的激活,qRT-PCR结果亦显示,体内、体外实验中LPS组炎症因子白介素6(interleukin-6, IL-6)mRNA水平显著上调(P<0.05),FPN的mRNA水平显著降低;与LPS组相比,LPS+Fer-1组与LPS+DFO组IL-6与铁调素mRNA表达均明显下调,FPN蛋白与mRNA表达量均有所恢复。

|
| 图 6 铁死亡抑制剂通过调控IL-6/STAT3通路抑制铁调素降解FPN A:Western印迹法检测小鼠肾脏FPN表达;B:Western印迹法检测小鼠肾脏P-STAT3激活情况;C:小鼠肾脏IL-6 mRNA水平;D:小鼠肾脏铁调素mRNA水平;E:小鼠肾脏FPN mRNA水平。F~J是体外HK-2细胞相应实验检测结果。*P<0.05与对照组相比,**P<0.01与对照组相比,△P<0.05与LPS组相比,△△P<0.01与LPS组相比。IL-6:白介素6;FPN:膜铁转运蛋白;STAT3:信号转导和转录激活因子3;P-STAT3:磷酸化信号转导和转录激活因子3。 |
脓毒症是由宿主对感染反应失调而引起的危及生命的器官功能障碍综合征[15],S-AKI是脓毒症常见并发症,在脓毒症早期即可出现,具有高发病率与高死亡率的特征。流行病学研究显示,脓毒症是ICU住院患者AKI的最常见诱因,AKI也是脓毒症患者死亡的独立危险因素[16-17]。S-AKI发病机制十分复杂,亟需探索S-AKI有效防治策略。
铁死亡作为不同于细胞凋亡的调节性细胞死亡(regulated cell death, RCD)方式,在多种急慢性肾脏病中被报道[18],GPX4基因缺陷小鼠出生2周内即死于大量肾小管坏死和急性肾损伤[19],提示肾脏可能是铁死亡的重要靶器官之一。此外,也有文献显示铁死亡参与了脓毒症相关的其他脏器损伤,如脓毒症心肌病与急性肺损伤等[20-21]。因此,铁死亡很有可能在S-AKI中起到重要作用,值得深入研究。目前,铁死亡与疾病相关的文献众多,但主要围绕脂质氧化相关通路进行探讨[22],对于铁死亡过程中细胞铁代谢及其相应机制的研究报道较罕见。
FPN是目前已知的唯一介导铁离子出胞的离子通道蛋白,定位于细胞膜上,仅允许铁以亚铁离子的形式转运出胞[23]。游离的亚铁离子构成了胞内LIP,可以通过芬顿反应等形式激发自由基生成,参与细胞氧化应激与脂质过氧化[24]。Bao等[25]发现铁输出蛋白FPN的减少参与了阿尔茨海默病患者神经元丢失和记忆障碍,强调铁死亡在该病发病机制中的重要作用。铁调素是一种内源性抗菌多肽,能够结合FPN使其内化降解,调控机体铁代谢[26]。STAT3是铁调素上游重要启动子,IL-6可以激活STAT3诱导铁调素表达[27]。Pan等[28]研究证实在小鼠单侧输尿管结扎模型中,肾源性铁调素水平升高促进FPN降解,诱导细胞发生铁过载。本研究通过构建脓毒症体内外模型发现,铁死亡是S-AKI中肾小管上皮细胞的一种重要死亡方式,LPS抑制肾脏和肾小管上皮细胞FPN表达,FPN减少可以诱导LIP和脂质过氧化水平增加等铁死亡表型,而这与铁调素水平升高有关。脓毒症环境中铁调素上游启动子STAT3可被IL-6激活,使用铁死亡抑制剂Fer-1或DFO均能抑制IL-6/STAT3通路的激活,减少铁调素生成,避免FPN降解,从而减轻LPS诱导的S-AKI。
综上所述,本研究利用体内外模型证实铁死亡抑制剂Fer-1与DFO对LPS诱导的S-AKI的保护作用。LPS通过促进铁调素降解FPN触发铁死亡参与脓毒症相关急性肾损伤的病理生理机制,铁死亡抑制剂通过抑制铁调素启动子上游IL-6/STAT3通路减少铁调素生成,保护FPN不被降解,避免胞内LIP扩大,进而抑制铁死亡,改善S-AKI。FPN参与了铁死亡反应过程,探索使用铁死亡抑制剂等方式保护FPN,抑制细胞LIP累积,可以为S-AKI的防治提供新的治疗靶点。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
RONCO C, BELLOMO R, KELLUM J A. Acute kidney injury[J]. Lancet, 2019, 394(10212): 1949-1964.
[DOI]
|
| [2] |
HOSTE E A J, BAGSHAW S M, BELLOMO R, et al. Epidemiology of acute kidney injury in critically ill patients: the multinational AKI-EPI study[J]. Intensive Care Med, 2015, 41(8): 1411-1423.
[DOI]
|
| [3] |
UCHINO S, KELLUM J A, BELLOMO R, et al. Acute renal failure in critically ill patients: a multinational, multicenter study[J]. JAMA, 2005, 294(7): 813-818.
[DOI]
|
| [4] |
BAGSHAW S M, LAPINSKY S, DIAL S, et al. Acute kidney injury in septic shock: clinical outcomes and impact of duration of hypotension prior to initiation of antimicrobial therapy[J]. Intensive Care Med, 2009, 35(5): 871-881.
[DOI]
|
| [5] |
DELLEPIANE S, MARENGO M, CANTALUPPI V. Detrimental cross-talk between sepsis and acute kidney injury: new pathogenic mechanisms, early biomarkers and targeted therapies[J]. Crit Care, 2016, 20: 61.
[DOI]
|
| [6] |
KUWABARA S, GOGGINS E, OKUSA M D. The pathophysiology of Sepsis-associated AKI[J]. Clin J Am Soc Nephrol, 2022, 17(7): 1050-1069.
[DOI]
|
| [7] |
DIXON S J, LEMBERG K M, LAMPRECHT M R, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072.
[DOI]
|
| [8] |
YANG W S, STOCKWELL B R. Ferroptosis: death by lipid peroxidation[J]. Trends Cell Biol, 2016, 26(3): 165-176.
[DOI]
|
| [9] |
MARTIN-SANCHEZ D, RUIZ-ANDRES O, POVEDA J, et al. Ferroptosis, but not necroptosis, is important in nephrotoxic folic acid-induced AKI[J]. J Am Soc Nephrol, 2017, 28(1): 218-229.
[DOI]
|
| [10] |
LI S W, ZHENG L S, ZHANG J, et al. Inhibition of ferroptosis by up-regulating Nrf2 delayed the progression of diabetic nephropathy[J]. Free Radic Biol Med, 2021, 162: 435-449.
[DOI]
|
| [11] |
ZHANG X Q, LI L X, DING H, et al. Ferroptosis promotes cyst growth in autosomal dominant polycystic kidney disease mouse models[J]. J Am Soc Nephrol, 2021, 32(11): 2759-2776.
[DOI]
|
| [12] |
DONOVAN A, LIMA C A, PINKUS J L, et al. The iron exporter ferroportin/Slc40a1 is essential for iron homeostasis[J]. Cell Metab, 2005, 1(3): 191-200.
[DOI]
|
| [13] |
DEV S, KUMARI S, SINGH N, et al. Role of extracellular Hydrogen peroxide in regulation of iron homeostasis genes in neuronal cells: implication in iron accumulation[J]. Free Radic Biol Med, 2015, 86: 78-89.
[DOI]
|
| [14] |
YAO X, ZHANG Y, HAO J, et al. Deferoxamine promotes recovery of traumatic spinal cord injury by inhibiting ferroptosis[J]. Neural Regen Res, 2019, 14(3): 532-541.
[DOI]
|
| [15] |
SINGER M, DEUTSCHMAN C S, SEYMOUR C W, et al. The third international consensus definitions for Sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810.
[DOI]
|
| [16] |
CHERTOW G M, SOROKO S H, PAGANINI E P, et al. Mortality after acute renal failure: models for prognostic stratification and risk adjustment[J]. Kidney Int, 2006, 70(6): 1120-1126.
[DOI]
|
| [17] |
张宇慧, 杨莉. 脓毒症相关急性肾损伤[J]. 临床内科杂志, 2022, 39(6): 372-376. ZHANG Y H, YANG L. Sepsis associated acute kidney injury[J]. J Clin Intern Med, 2022, 39(6): 372-376. [DOI] |
| [18] |
LIN Y X, XU W Q, HOU Y F, et al. The multifaceted role of ferroptosis in kidney diseases[J]. Chem Biol Interact, 2022, 365: 110107.
[DOI]
|
| [19] |
FRIEDMANN ANGELI J P, SCHNEIDER M, PRONETH B, et al. Inactivation of the ferroptosis regulator Gpx4 triggers acute renal failure in mice[J]. Nat Cell Biol, 2014, 16(12): 1180-1191.
[DOI]
|
| [20] |
LI N, WANG W, ZHOU H, et al. Ferritinophagy-mediated ferroptosis is involved in sepsis-induced cardiac injury[J]. Free Radic Biol Med, 2020, 160: 303-318.
[DOI]
|
| [21] |
HE R Y, LIU B H, XIONG R, et al. Itaconate inhibits ferroptosis of macrophage via Nrf2 pathways against sepsis-induced acute lung injury[J]. Cell Death Discov, 2022, 8(1): 43.
[DOI]
|
| [22] |
JIANG X J, STOCKWELL B R, CONRAD M. Ferroptosis: mechanisms, biology and role in disease[J]. Nat Rev Mol Cell Biol, 2021, 22(4): 266-282.
[DOI]
|
| [23] |
DE DOMENICO I, WARD D M, DI PATTI M C, et al. Ferroxidase activity is required for the stability of cell surface ferroportin in cells expressing GPI-ceruloplasmin[J]. EMBO J, 2007, 26(12): 2823-2831.
[DOI]
|
| [24] |
PHILPOTT C C, PATEL S J, PROTCHENKO O. Management versus miscues in the cytosolic labile iron pool: the varied functions of iron chaperones[J]. Biochim Biophys Acta Mol Cell Res, 2020, 1867(11): 118830.
[DOI]
|
| [25] |
BAO W D, PANG P, ZHOU X T, et al. Loss of ferroportin induces memory impairment by promoting ferroptosis in Alzheimer's disease[J]. Cell Death Differ, 2021, 28(5): 1548-1562.
[DOI]
|
| [26] |
NEMETH E, TUTTLE M S, POWELSON J, et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization[J]. Science, 2004, 306(5704): 2090-2093.
[DOI]
|
| [27] |
WRIGHTING D M, ANDREWS N C. Interleukin-6 induces hepcidin expression through STAT3[J]. Blood, 2006, 108(9): 3204-3209.
[DOI]
|
| [28] |
PAN S, QIAN Z M, CUI S Y, et al. Local hepcidin increased intracellular iron overload via the degradation of ferroportin in the kidney[J]. Biochem Biophys Res Commun, 2020, 522(2): 322-327.
[DOI]
|
 2023, Vol. 30
2023, Vol. 30


