2. 厦门市影像医学临床医学研究中心,厦门 361015;
3. 复旦大学附属中山医院神经内科,上海 200032;
4. 复旦大学附属中山医院厦门医院神经内科,厦门 361015;
5. 通用电气医疗集团磁共振研发部,上海 201203;
6. 复旦大学附属中山医院放射科,上海 200032
2. Xiamen Municipal Clinical Research Center for Medical Imaging, Xiamen 361015, Fujian, China;
3. Department of Neurology, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
4. Department of Neurology, Zhongshan Hospital, Fudan University (Xiamen Branch), Xiamen 361015, Fujian, China;
5. MR Research, GE Healthcare, Shanghai 201203, China;
6. Department of Radiology, Zhongshan Hospital, Fudan University, Shanghai 200032, China
帕金森病(Parkinson disease, PD)是中老年人群常见的神经退行性疾病,包括运动和非运动症状。轻度认知障碍(mild cognitive impairment, MCI)是PD患者最常见的非运动症状之一,也是PD痴呆的重要危险因素[1],可加重患者抑郁、运动障碍等症状。截至目前,MCI的病理生理机制仍不明确。多巴胺能系统功能减退是PD的核心病理改变,与PD运动症状和非运动症状相关,包括认知功能障碍[2]。多巴胺能药物不仅可以改善PD的运动症状,还能影响其认知状态[3]。黑质(substantia nigra, SN)神经黑色素成像研究显示,SN退变与PD运动、认知和情绪改变均相关[4];多巴胺转运蛋白(dopamine transporter, DAT)功能成像提示,纹状体多巴胺减少与PD-MCI相关[5]。多巴胺能系统通路之一的黑质-纹状体系统的铁异常沉积是PD病理生理学特征之一[2, 6-7]。此外,研究[8]显示红核(red nucleus,RN)、SN与齿状核(dentate nucleus,DN)间存在功能网络连接。基于此,本研究假设:黑质-纹状体等脑深部核团异常铁沉积可能与PD-MCI的神经机制相关。
尽管既往研究显示脑内异常铁沉积与PD认知障碍相关[9-11],但存在以下影响因素:(1)多纳入服药患者,难以避免抗PD药物治疗对于研究结果的潜在影响[12];(2)PD患者早期轻度认知功能减退的临床表现具有异质性及多样性[13],既往研究多采用蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA)等痴呆初筛量表,难以细化受累认知域。定量磁敏感图(quantitative susceptibility mapping, QSM)是新型的磁共振图像后处理技术[14],能在体无创、敏感、准确地定量测定脑内铁含量,并能清晰显示包括黑质-纹状体系统在内的皮质下核团的解剖学结构[15]。本研究选择初诊未治PD患者,采用QSM技术明确PD-MCI患者黑质-纹状体为主的脑深部核团的铁沉积特征,以及PD患者铁沉积与认知变化(包括各认知域)的相关性,探讨脑深部核团异常铁沉积在PD轻度认知功能变化中的可能作用。
1 资料与方法 1.1 研究对象选择2016年10月至2017年12月复旦大学附属中山医院初诊未治的PD患者34例,包括22例PD认知正常(PD with normal cognition, PD-NC)患者和12例PD伴MCI(PD-MCI)患者。收集同时间段社区招募的25名健康受试者作为对照组(healthy controls,HCs)。所有受试者接受病史采集、临床认知量表评估及MRI检查。PD组纳入标准:符合国际运动障碍学会(the Movement Disorder Society, MDS)PD临床诊断标准[16]。PD组排除标准:(1)接受过抗帕金森病治疗;(2)有脑损伤或其他神经系统疾病证据;(3)符合PD痴呆诊断标准;(4)严重焦虑、抑郁和精神分裂症等精神疾病史;(5)起病年龄≥40岁。对照组纳入标准:(1)无颅脑外伤、肿瘤、卒中、神经精神疾病史;(2)一级亲属无PD或特发性震颤等相关病史。本研究获得复旦大学附属中山医院伦理委员会批准(B2016-073R),所有受试者知情并签署知情同意书。
1.2 研究方法 1.2.1 PD分组根据MDS工作组2012年推荐的Ⅱ级诊断标准[17]:在每个领域(记忆、注意力、执行、语言、视空间功能)至少进行2项神经心理学测试,测试得分低于正常人平均值1.5个标准差即为异常,≥2项神经心理学测试异常的PD患者纳入PD-MCI组,不符合PD-MCI标准的PD患者纳入PD-NC组。对照组进行同样测试。
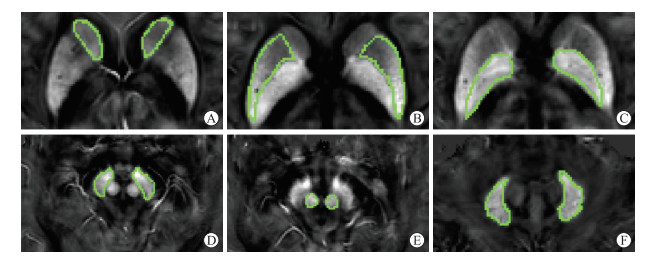
1.2.2 MRI扫描方案和后处理采用3.0-Tesla磁共振(DiscoveryTM MR750, GE Healthcare, 美国)采集图像。所有受检者行常规磁共振扫描序列(T1WI、T2WI、T2-FLAIR及DWI)和三维扰相GRE T2*WI序列,后者扫描参数为:重复时间(TR)51.5 ms;回波数16;第1个回波时间(TE)2.9 ms;TE间隔3 ms;翻转角12°;视野22 cm;矩阵220×220;层厚2 mm;加速因子2;层数66。如既往研究所述步骤将T2*图像后处理为QSM图像[18]。将所有QSM图像导入MRIcro( http://www.micro.com)软件,运用手动测量方式分别勾画感兴趣区(region of interests, ROI)[19]:双侧SN、RN、壳核(putamen, PU)、苍白球(globus pallidus, GP)、尾状核(caudate nucleus, CN)头、DN,得到QSM值(图 1),由1名具有5年以上神经系统MRI诊断经验的医师对图像进行ROI区的绘制测量,每个部位测量2次取平均值。另请1名具有5年以上神经系统MRI诊断经验的医师重复上述测量方法以检测观察者间重复性。
|
| 图 1 基于定量磁敏感图脑深部核团ROI勾画模式图 A: 尾状核头; B: 壳核; C: 苍白球; D: 黑质; E: 红核; F: 齿状核。ROI: 感兴趣区。 |
收集受试者的一般资料,包括年龄、性别、受教育程度等,评估神经心理认知情况和PD严重程度。采用老年抑郁量表(geriatric depression scale, GDS)评估受试者抑郁状态。
1.3.1 神经心理认知评估包括简易精神状态检查(Mini-Mental State Examination,MMSE)以及各认知领域功能评估[20]。(1)记忆力:Rey-Osterrieth复杂图形测验延迟回忆(delayed recall of the Rey-Osterrieth complex figure test, CFT-delay),听觉词语学习测验(auditory verbal learning test, AVLT),记录AVLT总分(AVLT-T)。(2)语言:Boston命名测验(Boston naming test, BNT),动物流畅性测验(animal fluency test, AFT)。(3)注意力:符号数字转换测验(symbol digit modalities test, SDMT),连线测试-A(Trail Making Test-A, TMT-A)。(4)视空间:Rey-Osterrieth复杂图形测验-模仿(copy task of Rey-Osterrieth complex figure test, CFT-copy),画钟测验(clock drawing test, CDT)。(5)执行:Stroop色词测验(Stroop color and word test, CWT),记录CWT时间(CWT time)和CWT正确数(CWT right);连线测试-B(TMT-B)。
1.3.2 PD严重程度评定采用Hoehn-Yahr(H-Y)分级及统一帕金森病评分量表(Unified Parkinson’s Disease Rating Scale, UPDRS)第3部分(UPDRS-Ⅲ)进行评估[17]。
1.4 统计学处理采用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料以̅x±s表示,采用独立样本t检验;不符合正态分布的以M(P25,P75)表示,采用Mann-Whitney U检验。计数资料以n(%)表示,采用χ2检验。多组间比较采用单因素方差分析和Kruskal-Wallis H检验,事后检验采用Bonferroni法。相关性分析采用偏相关,控制年龄、性别、受教育年限、UPDRS-Ⅲ及GDS因素,分析各认知量表得分与各ROI磁敏感值的相关性。采用多元线性回归分析铁沉积对认知功能的影响。采用组内相关系数评价观察者内一致性。检验水准(α)为0.05。
2 结果 2.1 基线资料结果(表 1)显示:3组受试者的性别、年龄差异无统计学意义。3组受试者的受教育年限差异有统计学意义(P=0.001),其中PD-MCI组的受教育年限显著短于HCs组(P<0.05)。PD严重程度方面,PD-MCI组与PD-NC组的病程、UPDRS-Ⅲ、H-Y分级差异均无统计学意义。PD-MCI组和PD-NC组的平均H-Y得分均<2.5分,提示入组的PD患者均为疾病早期。3组受试者的GDS评分,差异有统计学意义(P<0.001)。事后检验显示,PD-MCI组和PD-NC组的GDS评分均显著高于HCs组(P<0.05),而PD-MCI组和PD-NC组的差异无统计学意义。
| 指标 | HCs组(n=25) | PD-NC组(n=22) | PD-MCI组(n=12) | 统计量 | P值 |
| 年龄/岁 | 63.20±6.96 | 65.59±7.61 | 68.29±10.128 | 1.294 | 0.282 |
| 男性n(%) | 10(40.0) | 9(40.9) | 5(41.7) | 0.010 | 0.995 |
| 受教育年限/年 | 12.00(10.50, 15.00) | 9.50(9.00, 12.00) | 7.50(3.00, 10.75)△ | 14.380 | 0.001 |
| GDS/分 | 4.00(2.50, 5.50) | 9.00(3.75, 13.25)▽ | 14.00(9.00, 23.00)* | 18.603 | <0.001 |
| PD严重程度 | |||||
| 病程/月 | 21.41±18.44 | 17.17±9.32 | ﹣0.144 | 0.885 | |
| UPDRS-Ⅲ/分 | 16.68±9.52 | 19.33±10.82 | ﹣0.740 | 0.465 | |
| H-Y/分 | 1.23±0.43 | 1.38±0.64 | 0.655 | 0.513 | |
| 认知评估 | |||||
| MMSE/分 | 30.00(28.00, 30.00) | 29.00(23.00, 29.25) | 26.50(23.00, 28.00)*△ | 13.305 | 0.001 |
| CFT-delay/分 | 16.08±5.55 | 15.91±7.4 | 8.57±6.60*△ | 6.643 | 0.003 |
| AVLT-T/分 | 40.83±11.61 | 30.73±10.16▽ | 22.57±3.55△ | 14.358 | <0.001 |
| BNT/分 | 27.00(23.50, 28.00) | 25.00(24.00, 27.00) | 21.00(18.00, 22.00)*△ | 14.463 | 0.001 |
| AFT/分 | 17.00(14.00, 23.00) | 17.00(13.75, 23.25) | 13.50(9.00, 16.25)* | 7.513 | 0.023 |
| SDMT/分 | 45.54±11.70 | 37.09±8.05▽ | 25.00±10.03*△ | 23.193 | <0.001 |
| TMT-A/s | 47.00(39.50, 57.00) | 55.50(44.50, 68.00) | 100.00(69.25, 207.00)*△ | 17.249 | <0.001 |
| CFT-copy/分 | 33.00(31.00, 34.50) | 32.50(30.00, 34.00) | 31.75(25.25, 33.25) | 3.015 | 0.221 |
| CDT/分 | 9.00(9.00, 10.00) | 9.00(8.75, 10.00) | 9.00(7.00, 9.00) | 4.863 | 0.088 |
| CWT time/s | 61.00(56.00, 80.50) | 77.00(66.00, 101.25) | 98.00(82.00, 106.00)△ | 13.542 | 0.001 |
| CWT right/个 | 49.00(45.50, 50.00) | 47.50(43.00, 49.25) | 47.00(44.00, 49.00) | 3.762 | 0.152 |
| TMT-B/s | 116.25±39.06 | 145.23±41.68 | 200.29±51.08*△ | 11.973 | <0.001 |
| GDS:老年抑郁量表;UPDRS-Ⅲ:统一帕金森病评分量表第3部分;H-Y:Hoehn-Yahr分级;MMSE:简易精神状态检查;CFT-delay:Rey-Osterrieth复杂图形测验延迟回忆;AVLT-T:听觉词语学习测验总分;BNT:Boston命名测验;AFT:动物流畅性测验;SDMT:符号数字转换测验;TMT-A:连线测试-A;CFT-copy:Rey-Osterrieth复杂图形测验-模仿;CDT:画钟测验;CWT time:Stroop色词测验时间;CWT right:Stroop色词测验正确数;TMT-B:连线测试-B。*P<0.05与PD-NC组相比;△P<0.05与HCs组相比;▽P<0.05与HCs组相比。事后检验P值均为校正后P值。 | |||||
结果(表 1)显示:PD-MCI组、PD-NC组和HCs组的MMSE评分依次增高,差异有统计学意义(P=0.001)。事后检验显示,PD-MCI组MMSE评分显著低于PD-NC组和HCs组(P<0.05)。
2.2.2 各领域认知量表结果(表 1)显示:(1)记忆力方面,PD-MCI组、PD-NC组和HCs组CFT-delay评分依次增高,3组差异有统计学意义(P=0.003);事后检验显示,PD-MCI组评分显著低于PD-NC组和HCs组(P<0.05)。PD-MCI组、PD-NC组、HCs组的AVLT-T评分依次升高,3组差异有统计学意义(P<0.001);事后检验显示,PD-MCI组和PD-NC组评分显著低于HCs组(P<0.05)。(2)语言方面,3组受试者BNT评分差异有统计学意义(P=0.001);事后检验显示,PD-MCI组评分显著低于PD-NC组和HCs组(P<0.05)。3组受试者AFT评分差异有统计学意义(P=0.023),事后检验显示,PD-MCI组评分显著低于PD-NC组(P<0.05)。(3)注意力方面,PD-MCI组、PD-NC组、HCs组SDMT评分依次增高,3组差异有统计学意义(P<0.001)。3组受试者TMT-A差异有统计学意义(P<0.001);事后检验显示,PD-MCI组显著高于PD-NC组和HCs组(P<0.05)。(4)视空间方面,3组受试者的CFT-copy、CDT评分差异无统计学意义(P>0.05)。(5)执行方面,3组受试者的CWT time、TMT-B测验差异有统计学意义(P=0.001, P<0.001);事后检验显示PD-MCI组CWT time显著长于HCs组(P<0.05),TMT-B评分显著高于HCs组(P<0.05)。3组受试者CWT right差异无统计学意义(P>0.05)。
2.3 皮质下脑深部核团QSM值各ROI测量值一致性检验显示,观察者内相关系数≥0.858,观察者间相关系数≥0.837。结果(表 2)显示:3组受试者的双侧SN、双侧RN、双侧PU、左侧GP差异有统计学意义。事后检验显示,PD-MCI组在双侧SN、双侧RN、双侧PU、左侧DN的QSM值显著高于HCs组(P<0.05)。PD-MCI组在右侧RN、右侧PU的QSM值显著高于PD-NC组(P<0.05),PD-NC组右侧SN的QSM值显著高于HCs组(P<0.05)。
| 单位:ppm | |||||||||||||||||||||||||||||
| ROI测量区域 | HCs组(n=25) | PD-NC组(n=22) | PD-MCI组(n=12) | 统计量 | P值 | ||||||||||||||||||||||||
| DN-R | 0.076 4±0.024 9 | 0.081 8±0.028 9 | 0.084 7±0.021 7 | 1.278 | 0.287 | ||||||||||||||||||||||||
| DN-L | 0.071 4±0.025 2 | 0.078 2±0.026 4 | 0.093 4±0.029 9△ | 3.137 | 0.051 | ||||||||||||||||||||||||
| SN-R | 0.079 6±0.012 2 | 0.099 7±0.025 2▽ | 0.102 0±0.015 4△ | 11.762 | <0.001 | ||||||||||||||||||||||||
| SN-L | 0.084 3±0.013 4 | 0.102 7±0.029 5 | 0.103 4±0.029 3△ | 6.870 | 0.002 | ||||||||||||||||||||||||
| RN-R | 0.087 2±0.025 3 | 0.088 8±0.020 6 | 0.102 9±0.019 3*△ | 5.245 | 0.008 | ||||||||||||||||||||||||
| RN-L | 0.090 9±0.023 3 | 0.092 9±0.019 2 | 0.094 6±0.024 7△ | 3.942 | 0.025 | ||||||||||||||||||||||||
| GP-R | 0.128 0±0.037 5 | 0.127 7±0.039 7 | 0.149 9±0.060 8 | 5.825 | 0.054 | ||||||||||||||||||||||||
| GP-L | 0.135 9±0.043 9 | 0.130 6±0.037 2 | 0.158 7±0.058 6 | 6.036 | 0.049 | ||||||||||||||||||||||||
| PU-R | 0.065 7±0.017 2 | 0.064 3±0.018 2 | 0.087 1±0.023 6*△ | 11.197 | 0.004 | ||||||||||||||||||||||||
| PU-L | 0.062 4±0.018 1 | 0.068 2±0.017 5 | 0.081 7±0.018 9△ | 9.523 | 0.009 | ||||||||||||||||||||||||
| CN-R | 0.042 0±0.011 8 | 0.044 1±0.009 8 | 0.055 1±0.014 1 | 2.727 | 0.074 | ||||||||||||||||||||||||
| CN-L | 0.041 8±0.011 7 | 0.050 2±0.012 8 | 0.040 3±0.013 0 | 2.895 | 0.064 | ||||||||||||||||||||||||
| ROI:感兴趣区;QSM:定量磁敏感图;DN-R:右侧齿状核;DN-L:左侧齿状核;SN-R:右侧黑质;SN-L:左侧黑质;RN-R:右侧红核;RN-L:左侧红核;GP-R:右侧苍白球;GP-L:左侧苍白球;PU-R:右侧壳核;PU-L:左侧壳核;CN-R:右侧尾状核头;CN-L:左侧尾状核头。*P<0.05与PD-NC组相比;△P<0.05与HCs组相比;▽P<0.05与HCs组相比。事后检验P值均为校正后P值。 | |||||||||||||||||||||||||||||
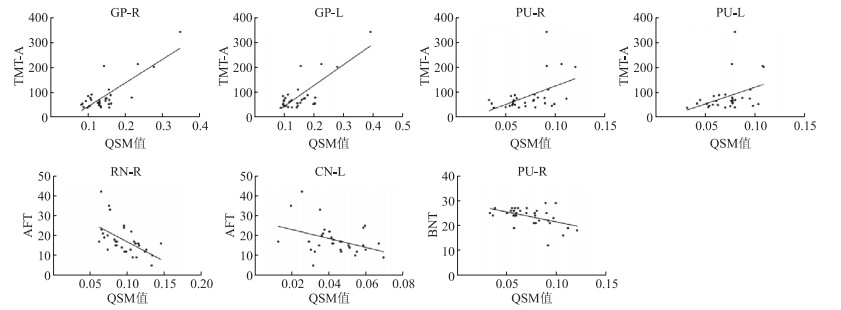
结果(图 2)显示:双侧GP、PU的QSM值与TMT-A评分均正相关(右侧GP:r=0.555, P=0.005; 左侧GP:r=0.470, P=0.020;右侧PU:r=0.479, P=0.018;左侧PU:r=0.430, P=0.036);右侧RN、左侧CN的QSM值与AFT评分负相关(右侧RN:r=﹣0.457, P=0.025;左侧CN:r=﹣0.524, P=0.010);右侧PU的QSM值与BNT评分负相关(r=﹣0.445, P=0.033)。其余ROI的QSM值与各认知域量表评分未发现相关性。
|
| 图 2 各ROI的QSM值与各认知量表的相关性分析 TMT-A:连线测试-A;AFT:动物流畅性测验;BNT:Boston命名测验;GP-R:右侧苍白球;GP-L:左侧苍白球;PU-R:右侧壳核;PU-L:左侧壳核;RN-R:右侧红核;CN-L:左侧尾状核头。 |
经双变量分析筛选对TMT-A有显著影响的因素,结果(表 3)显示:受教育年限、MMSE、右侧GP、右侧SN、右侧PU对TMT-A有显著影响;将这些因素进一步行逐步多元线性回归分析显示,TMT-A主要受受教育年限、MMSE和右侧GP的QSM值影响。左、右侧ROI间QSM值具有共线性,因此仅纳入单侧进行分析。左侧ROI回归分析结果与右侧相似。
| 变量 | 双变量分析 | 多元线性回归分析 | |||
| R | P值 | β (95% CI) | P值 | ||
| 年龄 | 0.262 | 0.147 | |||
| 性别 | ﹣0.100 | 0.955 | |||
| 受教育年限 | ﹣0.556 | 0.001 | ﹣4.002 (﹣7.418~﹣0.585) | 0.023 | |
| UPDRS-Ⅲ | 0.270 | 0.135 | |||
| MMSE | ﹣0.812 | <0.001 | ﹣14.72 (﹣20.853~﹣8.587) | <0.001 | |
| SN-R | 0.577 | 0.001 | |||
| PU-R | 0.496 | 0.004 | |||
| GP-R | 0.813 | <0.001 | 421.864 (140.325~703.403) | 0.005 | |
| TMT-A:连线测试-A;UPDRS-Ⅲ:统一帕金森病评分量表第3部分;MMSE:简易精神状态检查;SN-R:右侧黑质;PU-R:右侧壳核;GP-R:右侧苍白球。 | |||||
PD是中老年人群常见的神经退行性疾病,认知功能障碍是其最常见的非运动症状之一。本研究显示,PD-MCI组较PD-NC组在RN、PU铁沉积显著增加,且PD患者中,皮质下脑深部核团铁异常沉积与注意力、语言功能受损相关。本研究中PD组均为初诊未服药患者,消除了药物对研究结果的潜在影响。
MCI是PD常见的非运动症状,20%~33%的PD患者在诊断时就存在MCI,其中多达80%的PD-MCI患者在起病12年内进展为PD痴呆[21]。本研究初诊未治的PD患者中,约35%存在MCI,与既往报道[22]相符。基于QSM技术,本研究发现,PD-MCI组双侧RN、SN、PU和左侧DN的QSM值显著高于HCs组,右侧RN、PU的QSM值显著高于PD-NC组。Zhao等[23]研究显示,PD-MCI组相较PD-NC组在SN、RN、PU等部位出现显著铁沉积,与本研究结果类似;而Uchida等[24]研究显示,与PD-NC组相比,PD-MCI组在楔叶、楔前叶、CN等部位铁沉积显著增加;该团队另一项研究[25]显示,PD-MCI组相较PD-NC组在CN、PU铁沉积增加。结合本研究结果,提示PD-MCI较PD-NC具有更广泛、更显著的脑铁沉积,以SN、RN、基底节区核团受累为主[26]。
PD-MCI患者临床表现多样,以注意力和执行功能领域缺陷最为常见[13]。Zhao等[23]基于体素分析PD-MCI与PD-NC患者全脑QSM值差异的研究显示:SN、RN、GP、PU、海马、丘脑与MoCA-B负相关,但该研究未进行5个认知域进一步测量。Tambasco等[9]基于T2*WI分析PD患者认知功能与脑铁沉积关系的研究显示,SN、DN、CN、GP、PU、FWM的T2*值与语言正相关,其中PU与之强相关;而SN的T2*值与记忆正相关。Uchida等[25]基于图谱的QSM与123I-FP-CIT SPECT分析PD认知障碍与脑铁沉积关系的研究结果显示:CN的QSM值与MoCA、嗅觉功能评分负相关,其余脑区未发现相关性。本研究结果显示,GP、PU铁沉积与注意力受损相关,PU、RN、CN铁沉积与语言功能受损相关。本研究结果与既往研究结果的差异之处可能是由于入组对象服药情况、检查方法、图像处理方法不同。人类纹状体、丘脑底核、RN和SN有大量胆碱能神经分布(其密度按顺序减低)或支配。深部核团作为脑神经网络节点之一,直接或间接参与多个神经网络结构[27],结合本研究结果,提示深部核团异常铁沉积可能是造成PD轻度认知减退表型异质性的潜在影响因素。同时PD患者广泛脑铁沉积与各认知领域功能缺陷间的多处相关,提示认知功能障碍不能简单视为单个大脑区域的统一功能障碍,而是多网络、多区域的功能受损,其进一步的机制研究需联合弥散张量成像(DTI)、功能磁共振(fMRI)等多模态影像检查方法。
苍白球是基底节核团枢纽,接收来自前、中脑的输入,与PD运动、非运动症状均相关[28]。既往PD尸检结果对于GP铁沉积并无统一定论[29]。Guan等[30]研究显示,晚期PD患者GP铁沉积增加,Thomas等[11]的研究与本研究均未观察到早期PD患者GP铁沉积增加,而Uchida等[24]与本研究均发现早期PD-MCI患者GP铁沉积增加。此外,多元线性回归分析显示,GP铁沉积在TMT-A中产生显著影响,提示GP铁沉积或许是PD发生注意力减退的核心或枢纽区域。
本研究存在一定局限性。首先,本研究中PD的诊断基于临床标准,没有病理证实,同时未经基因检测排除基因突变型PD,尽管患者的发病年龄均≥40岁,但仍有遗传突变干扰研究结果的可能。其次,本研究为横断面研究,且纳入病例数较少,结果可能存在偏倚,未来开展增加样本量的纵向研究有助于验证本研究结果。最后,本研究使用手动勾画ROI,尽管观察者一致性较好,但仍存在主观、耗时等问题,全脑自动分割技术将有助于获得更精准、客观的数据,后续将联合多模态成像序列及深度学习等技术进行更深入的研究。
综上所述,本研究通过QSM技术显示,PD-MCI存在脑深部核团的广泛铁异常沉积,在PD患者中脑铁沉积与注意力、语言功能受损相关,提示铁异常沉积可能参与了PD患者认知功能障碍的病理生理过程。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
WILLIAMS-GRAY C H, FOLTYNIE T, BRAYNE C E G, et al. Evolution of cognitive dysfunction in an incident Parkinson's disease cohort[J]. Brain, 2007, 130(Pt 7): 1787-1798.
|
| [2] |
HIRANO S. Clinical implications for dopaminergic and functional neuroimage research in cognitive symptoms of Parkinson's disease[J]. Mol Med, 2021, 27(1): 40.
[DOI]
|
| [3] |
MOUSTAFA A A, SHERMAN S J, FRANK M J. A dopaminergic basis for working memory, learning and attentional shifting in Parkinsonism[J]. Neuropsychologia, 2008, 46(13): 3144-3156.
[DOI]
|
| [4] |
BIONDETTI E, GAURAV R, YAHIA-CHERIF L, et al. Spatiotemporal changes in substantia nigra neuromelanin content in Parkinson's disease[J]. Brain, 2020, 143(9): 2757-2770.
[DOI]
|
| [5] |
CHUNG S J, YOO H S, OH J S, et al. Effect of striatal dopamine depletion on cognition in de novo Parkinson's disease[J]. Parkinsonism Relat Disord, 2018, 51: 43-48.
[DOI]
|
| [6] |
WARD R J, ZUCCA F A, DUYN J H, et al. The role of iron in brain ageing and neurodegenerative disorders[J]. Lancet Neurol, 2014, 13(10): 1045-1060.
[DOI]
|
| [7] |
MAHONEY-SÁNCHEZ L, BOUCHAOUI H, AYTON S, et al. Ferroptosis and its potential role in the physiopathology of Parkinson's disease[J]. Prog Neurobiol, 2021, 196: 101890.
[DOI]
|
| [8] |
ZHANG H Y, TANG H, CHEN W X, et al. Mapping the functional connectivity of the substantia nigra, red nucleus and dentate nucleus: a network analysis hypothesis associated with the extrapyramidal system[J]. Neurosci Lett, 2015, 606: 36-41.
[DOI]
|
| [9] |
TAMBASCO N, PAOLINI PAOLETTI F, CHIAPPINIELLO A, et al. T2*-weighted MRI values correlate with motor and cognitive dysfunction in Parkinson's disease[J]. Neurobiol Aging, 2019, 80: 91-98.
[DOI]
|
| [10] |
HOU Y B, SHANG H F. Magnetic resonance imaging markers for cognitive impairment in Parkinson's disease: current view[J]. Front Aging Neurosci, 2022, 14: 788846.
[DOI]
|
| [11] |
THOMAS G E C, LEYLAND L A, SCHRAG A E, et al. Brain iron deposition is linked with cognitive severity in Parkinson's disease[J]. J Neurol Neurosurg Psychiatry, 2020, 91(4): 418-425.
[DOI]
|
| [12] |
FAHN S, OAKES D, SHOULSON I, et al. Levodopa and the progression of Parkinson's disease[J]. N Engl J Med, 2004, 351(24): 2498-2508.
[DOI]
|
| [13] |
MUSLIMOVIC D, POST B, SPEELMAN J D, et al. Cognitive profile of patients with newly diagnosed Parkinson disease[J]. Neurology, 2005, 65(8): 1239-1245.
[DOI]
|
| [14] |
宋娟, 李雨珊, 吴曦. 定量磁化率成像在帕金森病诊断、评估及手术方面的应用[J]. 中国临床医学, 2020, 27(4): 693-696. SONG J, LI Y S, WU X. Application of quantitative susceptibility mapping in diagnosis, evaluation and operation of Parkinson disease[J]. Chin J Clin Med, 2020, 27(4): 693-696. [URI] |
| [15] |
DEISTUNG A, SCHÄFER A, SCHWESER F, et al. Toward in vivo histology: a comparison of quantitative susceptibility mapping (QSM) with magnitude-, phase-, and R2*-imaging at ultra-high magnetic field strength[J]. NeuroImage, 2013, 65: 299-314.
[DOI]
|
| [16] |
POSTUMA R B, BERG D, STERN M, et al. MDS clinical diagnostic criteria for Parkinson's disease[J]. Mov Disord, 2015, 30(12): 1591-1601.
[DOI]
|
| [17] |
LITVAN I, GOLDMAN J G, TRÖSTER A I, et al. Diagnostic criteria for mild cognitive impairment in Parkinson's disease: Movement Disorder Society Task Force guidelines[J]. Mov Disord, 2012, 27(3): 349-356.
[DOI]
|
| [18] |
HE N Y, LING H W, DING B, et al. Region-specific disturbed iron distribution in early idiopathic Parkinson's disease measured by quantitative susceptibility mapping[J]. Hum Brain Mapp, 2015, 36(11): 4407-4420.
[DOI]
|
| [19] |
PERSSON N, WU J L, ZHANG Q, et al. Age and sex related differences in subcortical brain iron concentrations among healthy adults[J]. NeuroImage, 2015, 122: 385-398.
[DOI]
|
| [20] |
LI Y F, WANG C P, WANG J, et al. Mild cognitive impairment in de novo Parkinson's disease: a neuromelanin MRI study in locus coeruleus[J]. Mov Disord, 2019, 34(6): 884-892.
[DOI]
|
| [21] |
HELY M A, REID W G J, ADENA M A, et al. The Sydney multicenter study of Parkinson's disease: the inevitability of dementia at 20 years[J]. Mov Disord, 2008, 23(6): 837-844.
[DOI]
|
| [22] |
BROEDERS M, DE BIE R M A, VELSEBOER D C, et al. Evolution of mild cognitive impairment in Parkinson disease[J]. Neurology, 2013, 81(4): 346-352.
[DOI]
|
| [23] |
ZHAO Y, QU H, WANG W, et al. Assessing mild cognitive impairment in Parkinson's disease by magnetic resonance quantitative susceptibility mapping combined voxel-wise and radiomic analysis[J]. Eur Neurol, 2022, 85(4): 280-290.
[DOI]
|
| [24] |
UCHIDA Y, KAN H, SAKURAI K, et al. Voxel-based quantitative susceptibility mapping in Parkinson's disease with mild cognitive impairment[J]. Mov Disord, 2019, 34(8): 1164-1173.
[DOI]
|
| [25] |
UCHIDA Y, KAN H, SAKURAI K, et al. Magnetic susceptibility associates with dopaminergic deficits and cognition in parkinson's disease[J]. Mov Disord, 2020, 35(8): 1396-1405.
[DOI]
|
| [26] |
PYATIGORSKAYA N, SANZ-MORÈRE C B, GAURAV R, et al. Iron imaging as a diagnostic tool for Parkinson's disease: a systematic review and meta-analysis[J]. Front Neurol, 2020, 11: 366.
[DOI]
|
| [27] |
WYLIE K P, KLUGER B M, MEDINA L D, et al. Hippocampal, basal ganglia and olfactory connectivity contribute to cognitive impairments in Parkinson's disease[J]. Eur J Neurosci, 2023, 57(3): 511-526.
[DOI]
|
| [28] |
DONG J, HAWES S, WU J B, et al. Connectivity and functionality of the globus pallidus externa under normal conditions and Parkinson's disease[J]. Front Neural Circuits, 2021, 15: 645287.
|
| [29] |
ACOSTA-CABRONERO J, CARDENAS-BLANCO A, BETTS M J, et al. The whole-brain pattern of magnetic susceptibility perturbations in Parkinson's disease[J]. Brain, 2017, 140(1): 118-131.
[DOI]
|
| [30] |
GUAN X J, XUAN M, GU Q Q, et al. Regionally progressive accumulation of iron in Parkinson's disease as measured by quantitative susceptibility mapping[J]. NMR Biomed, 2017, 30(4).
[DOI]
|
 2023, Vol. 30
2023, Vol. 30


