原发心脏血管瘤少见,占心脏良性肿瘤的5%~10%,通常单发,临床症状通常与肿瘤部位、大小等相关[1-2]。心脏血管瘤是一类起源于心内膜、心肌或心包的良性血管瘤,组织形态学上可分为海绵状血管瘤、毛细血管瘤、静脉型血管瘤及非特殊型,许多肿瘤可混合不同组织类型。临床工作中,心脏肿瘤的血管内皮来源通过免疫组化检测较易识别,但对肿瘤良恶性的判断帮助不大。本研究通过回顾本中心23例心脏血管瘤,分析其临床经典形态学特征及一些少见细胞形态和生长模式。
1 资料与方法 1.1 一般资料在复旦大学附属中山医院病理数据系统中检索2015年至2021年有完整病案资料及病理切片的原发心脏血管瘤病例,共纳入23例。
1.2 方法标本均经4%的中性甲醛固定,常规脱水,石蜡包埋,采用4 μm厚切片,行H-E染色和免疫组化染色检测。在电子病例中获得患者的临床资料,包括性别、年龄、起病症状、既往史、术前术后影像学资料、手术记录和门诊随访记录。由3位高年主治病理医师复习病理切片,通过H-E染色观察记录肿瘤的主要生长方式,详细描述少见的结构、生长模式及间质变化。部分病例结合免疫组织化学染色协助确定肿瘤细胞来源。
1.3 随访23例患者均获得完整随访资料。随访资料包括电子病历记录的复查情况(门诊随访记录、常规超声心动图等影像学检查)及电话随访生存状态。随访时间截至2022年7月。
2 结果 2.1 临床资料共纳入23例原发心脏血管瘤(表 1)。男性11例,女性12例。年龄17~71岁,中位年龄56岁。10例患者通过体检发现;7例以胸闷气促起病;少数出现胸痛、下肢水肿、晕厥、头晕眩晕等症状。既往有高血压病史11例、糖尿病史2例、恶性肿瘤史2例。
| 病例 | 性别 | 年龄/岁 | 肿瘤生长部位 | 病灶数 | 肿瘤体积/cm³ | 病理形态特征 |
| 1 | 女 | 58 | 左房表面 | 单个 | 6×4×2 | 海绵状 |
| 2 | 女 | 62 | 右室表面 | 单个 | 5×4×2 | 海绵状 |
| 3 | 男 | 49 | 左室室间隔 | 单个 | 1×1×0.3 | 毛细血管型+部分非特殊型 |
| 4 | 男 | 53 | 心尖部表面 | 多个 | 5×4×2 0.8×0.5×0.5 |
海绵状 |
| 5 | 女 | 69 | 左房表面 | 单个 | 4.5×4×2 | 海绵状为主+5%区域细胞增生明显,与心肌边界不清 |
| 6 | 男 | 55 | 右室室间隔 | 单个 | 4×3×2 | 海绵状为主+少量毛细血管型 |
| 7 | 女 | 56 | 左房表面+心包 | 单个 | 5.5×3.5×2 | 海绵状为主+壁间增生梭形细胞 |
| 8 | 女 | 19 | 右室室间隔 | 单个 | 3×2×0.8 | 肌间毛细血管型 |
| 9 | 男 | 47 | 右房表面 | 单个 | 5×4.5×4 | 毛细血管型+少量静脉型 |
| 10 | 男 | 48 | 右室 | 单个 | 2×1.5×0.7 | 海绵状为主+壁间毛细血管型 |
| 11 | 男 | 61 | 左房表面 | 单个 | 5×4×1.5 | 海绵状为主 |
| 12 | 男 | 17 | 右室 | 单个 | 3×2.5×2.5 | 毛细血管型 |
| 13 | 女 | 44 | 右房表面 | 单个 | 9.5×5.5×5.0 | 静脉型 |
| 14 | 女 | 48 | 右房表面 | 单个 | 6×6×7 | 海绵状 |
| 15 | 男 | 56 | 右房 | 单个 | 4.5×3×1 | 海绵状为主 |
| 16 | 女 | 58 | 右室 | 单个 | 3.5×2.2×2 | 海绵状为主+局部实性细胞巢 |
| 17 | 女 | 66 | 右室 | 单个 | 4×4×3 | 海绵状为主+部分毛细血管型 |
| 18 | 男 | 61 | 右房房间隔表面 | 单个 | 3.1×2.6×1.3 | 海绵状为主 |
| 19 | 女 | 56 | 左室表面 | 单个 | 11.3×5.2×2 | 海绵状为主+少量静脉型 |
| 20 | 女 | 52 | 心尖部表面 | 单个 | 3×2.9×1.5 | 海绵状为主+部分毛细血管型 |
| 21 | 男 | 71 | 左房 | 单个 | 6×4×3 | 海绵状为主+部分毛细血管型 |
| 22 | 女 | 65 | 右室 | 单个 | 2.5×2.5×1.3 | 海绵状 |
| 23 | 男 | 58 | 心尖部表面 | 单个 | 3.5×2.3×2.8 | 海绵状 |
22例为单个病灶;1例为多发病灶,均位于心尖部表面,且患者伴肝脏多发血管瘤。单发病灶中,心腔内占位10例(右室5例、右室间隔2例、右房1例、左房1例、左室间隔1例),心脏表面占位13例(右房面4例、左房面4例、心尖部3例、右室面1例、左室面1例)。肿瘤最大径1.0~11.3 cm,平均4.4 cm。
影像学检查包括常规超声心动图、PET/CT或PET/MR等。23例患者均进行了常规超声心动图检查,主要表现为中等回声实质占位,但也可表现为低回声、高回声及不均匀回声等表现,其中2例未见占位。16例行PET/CT或PET/MR检查,13例诊断为良性可能,标准摄取值(standard uptake value, SUV)表现为不升高或轻度升高,SUV值最大3.6。病例1诊断为恶性病变可能,SUV值最大值3.1,病灶最大径6 cm,大量血性心包积液;病例13诊断为低度恶性,SUV值最大值3.1;病例19诊断为交界性肿瘤,SUV值最大约3.3。两项检查在心包积液的描述上较一致,8例有心包积液,表现为极少量至大量积液,呈淡黄色或血性。
2.2 组织病理学特征组织形态上,心脏血管瘤主要生长模式分为海绵状和毛细血管型。以海绵状形态为主的血管瘤18例,镜下表现为薄壁血管,相互交通,内衬扁平内皮细胞(图 1A)。含毛细血管瘤成分的血管瘤6例,其中4例为主要成分,镜下大部分血管腔不开放,间质疏松水肿,挤压血管呈裂隙状,内皮细胞呈卵圆形(图 1B)。静脉型血管瘤1例,镜下为厚壁血管,血管腔扩张,管腔形态不规则,腔内充满红细胞(图 1C)。1例多发性血管瘤中,均为海绵状血管瘤。
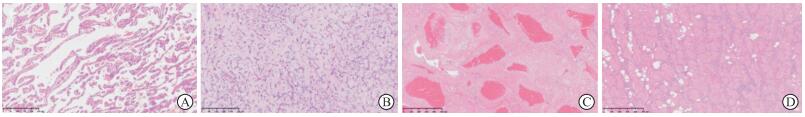
|
| 图 1 心脏血管瘤经典生长模式的H-E染色图 A:海绵状血管瘤;B:毛细血管瘤;C:静脉型血管瘤;D:肌间毛细血管瘤。Original magnification:×100。 |
其中1例(病例7)心脏血管瘤中出现不常见的细胞形态,肿瘤低倍镜下为海绵状血管瘤,中、高倍镜下海绵状血管瘤壁上可见增生的梭形细胞(图 2A),免疫组化结果示CD34、CD31(图 2B)和ERG阳性表达。
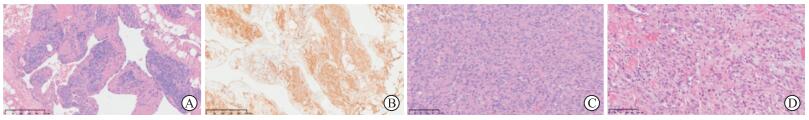
|
| 图 2 心脏血管瘤少见细胞形态及生长方式病理染色图 A:H-E染色显示海绵状生长,壁间可见增生梭形细胞;B:免疫组化显示腔内衬细胞及梭形细胞均表达CD31;C:H-E染色显示肿瘤细胞密集增生呈实性, 上皮样;D:H-E染色显示内衬细胞部分呈钉突状,与心肌穿插浸润生长,边界欠清。Original magnification(A、B):×100;Original magnification(C、D):×200。 |
血管瘤一般形成明显血管腔,肿瘤丰富时可出现实性生长,其内仍可见血管腔的形成(图 2C),少数病例出现复杂交通,被覆内皮细胞钉突状生长,部分血管瘤边界不清,与心肌细胞穿插生长(图 2D)。血管腔周围间质的变化多样,如片状出血、胶原变性、疏松水肿、钙化及骨化生。
2.3 免疫组化6例患者进行了免疫组化检测,主要针对组织中出现上皮样细胞、梭形细胞、细胞密度较高、血管腔不明显的病例,结果表明肿瘤细胞不均质性地表达CD34、CD31(图 2B)、FLI-1、ERG,Ki-67增殖指数均不足5%(1%~5%)。
2.4 治疗与预后23例患者均进行外科手术完整切除病灶,预后良好,随访均未发现肿瘤复发和相关死亡。
3 讨论心脏血管瘤是一类少见的心脏良性肿瘤,其发病率远低于黏液瘤,约占心脏原发肿瘤的2.8%[3]。心脏血管瘤常起病隐匿,很多患者通过体检偶然发现,且患者多有高血压病史,一些亚临床症状常被掩盖,患者出现胸闷、气促、胸痛、下肢水肿、头晕等症状可作为排查心脏占位的临床症状参考。部分患者既往可有先天性心脏病、肺动脉高压等疾病,常会掩盖心脏占位性疾病的临床表现。
心脏血管瘤常伴有心包积液(此类患者多有临床症状),大部分为清亮非血性液体,其发生与心脏腔内外占位无明确关联。肿瘤体积可以很小,偶然被发现,也可表现出巨大占位,部分病例可出血,形成大量心包积液,引起心包填塞,甚至死亡[4]。室间隔占位患者均为体检发现,无临床症状。体检发现心脏占位的患者中,均为单发病灶,80%无心包积液。心脏血管瘤病例以单发病灶为主,多发病灶较少[5],有时也会合并其他脏器内多发血管瘤,如合并肝内多发血管瘤,需要进一步相关检查明确心脏占位是否为全身性疾病的局部表现。
常规超声心动图是临床首选的排查心脏占位的检查技术,偶有个别位于心脏游离缘的病灶出现漏诊。当出现病灶体积较大、多个病灶、肌间生长、大量心包积液时,临床会选择18F-FDG PET/CT、PET/MR作为补充检查。18F-FDG摄取反映了肿瘤中糖酵解的代谢率,因此18F-FDG摄取的量化可支持心脏良恶性肿瘤的无创区分[6],但少部分病例会出现诊断偏倚或不排除性诊断,这些病变均位于心脏游离缘,SUV值最大值大于3.0,而组织上均以海绵状生长为主,未见恶性成分。
对心脏血管瘤的报道[7-9]多集中于经典组织形态及少见的临床症状上。本研究基于病理诊断工作实践进行回顾性分析,总结经典组织形态,并进行一些少见组织形态及生长方式的鉴别诊断。心脏血管瘤经典的常见组织形态以海绵状血管瘤和毛细血管瘤为主,与文献报道的基本一致。单纯以海绵状形态出现的较少,多以海绵状、毛细血管型、静脉型等组合生长的混合型血管瘤为主。肿瘤边界清楚,血管腔呈海绵状,内衬细胞温和无异型,缺乏病理性核分裂象及坏死均是良性血管瘤的诊断要点。当肿瘤细胞呈上皮样或梭形,出现复杂交通的血管腔结构、被覆内皮细胞钉突状生长、实性生长等组织形态时,首诊医生往往感觉有一定困难,会提交科室讨论。通过关注这些形态变化的特征,熟悉其鉴别诊断要点,才能做出正确诊断。
当肿瘤细胞呈上皮样时,要进一步区分是上皮样血管瘤还是上皮样血管内皮瘤,虽命名相似,但肿瘤性质不同。上皮样血管瘤属于良性肿瘤,以明显的上皮样内皮细胞增生为主,可形成小血管或实性片状增生。上皮样血管内皮瘤在心脏中罕见报道[10],属于低度恶性肿瘤,可独立存在,若合并血管瘤成分,应诊断为复合性血管内皮瘤。
梭形细胞血管瘤、Kaposi型血管内皮瘤和梭形细胞血管肉瘤的部分形态非常相似,梭形细胞血管瘤表现为海绵状血管瘤和梭形内皮细胞混合存在,细胞温和,边界较清。Kaposi样血管内皮瘤也是以梭形细胞增生为主,裂隙状血管腔内含红细胞,细胞可无异型,或表现为轻度异型,但重要的是,Kaposi样血管内皮瘤多呈浸润性生长,被纤维组织分隔呈多结节状,而梭形细胞血管肉瘤则表现出高级别的细胞学特征。少许的核分裂象和非肿瘤性坏死并非诊断升级的指标。免疫组化指标(CD34、CD31、ERG、FLI-1)可帮助鉴别病灶中出现的上皮样细胞及梭形细胞的血管内皮来源,有较高的灵敏度和特异度,良性肿瘤一般具有低增殖活性。
高分化血管肉瘤形态可完全模拟良性血管瘤,有时浸润性生长模式作为唯一的诊断要点。当血管肿瘤出现肌间生长、复杂交通的血管腔及多灶生长等生长方式时,肿瘤良恶性的诊断难度大。虽然肌间血管瘤中肿瘤细胞与心肌穿插生长,边界不清,但并未破坏心肌结构,也未引起间质反应,更多地表现为共生、推挤性生长。吻合状血管瘤,以复杂交通的血管腔和钉突状内皮细胞为诊断要点,与血管肉瘤内的生长方式和内衬细胞都有类似之处,但在瘤巢周边无浸润性生长。多发性血管瘤,每个病灶都无浸润性边界,且独立存在,需要与血管肉瘤的子灶进行鉴别。
肿瘤细胞常有一些伴随变化,包括显著出血、胶原化、黏液样变、钙化及局部骨化生等,也常见到血管腔内血栓形成及炎症细胞浸润。其中,以慢性炎症细胞为主,包括淋巴细胞及浆细胞,亦可出现大量的中性粒细胞浸润。这些伴随的变化引起血管腔之间厚薄变化及肿瘤体积、巨检质地的不同。
心脏血管瘤的发病机制并不明确,血管瘤的形成机制,尤其是婴儿型血管瘤,主要集中于潜在干细胞、缺氧和肾素血管紧张素系统的研究[11]。心脏局部的缺血缺氧、传导系统的紊乱、心内膜内皮细胞的迁移是否在血管瘤的形成中起一定作用,还需进一步研究探索。
综上所述,心脏血管瘤常在体检中被发现,以单发为主,腔内外均可发生,常见海绵状和毛细血管型。了解心脏血管瘤的少见形态有助于鉴别诊断。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
LI W D, TENG P, XU H F, et al. Cardiac hemangioma: a comprehensive analysis of 200 cases[J]. Ann Thorac Surg, 2015, 99(6): 2246-2252.
[DOI]
|
| [2] |
BASSO C, VALENTE M, POLETTI A, et al. Surgical pathology of primary cardiac and pericardial tumors[J]. Eur J Cardiothorac Surg, 1997, 12(5): 730-737.
[DOI]
|
| [3] |
REYNEN K. Frequency of primary tumors of the heart[J]. Am J Cardiol, 1996, 77(1): 107.
[DOI]
|
| [4] |
PEREZ RIVERA C J, FIGUEROA-CASANOVA R, OCHOA BONET C E, et al. Super large cardiac hemangioma in right atrium and inferior vena cava: case report[J]. J Cardiothorac Surg, 2019, 14(1): 186.
[DOI]
|
| [5] |
VACIRCA S R, NARDI P, FERLOSIO A, et al. Multifocal cardiac hemangioma[J]. J Card Surg, 2018, 33(6): 310-312.
[DOI]
|
| [6] |
YIN H Y, MAO W J, TAN H, et al. Role of 18F-FDG PET/CT imaging in cardiac and pericardial masses[J]. J Nucl Cardiol, 2022, 29(3): 1293-1303.
[DOI]
|
| [7] |
ZHAO H G, TAO T T, DAVIES H, et al. Right atrium hemangioma in patient with history of mixed-thrombus surgery[J]. J Card Surg, 2019, 34(5): 356-358.
[DOI]
|
| [8] |
GHAVIDEL A A, SAEDI S, AUSTINE N, et al. Extremely rare and giant cavernous cardiac hemangioma[J]. Turk Gogus Kalp Damar Cerrahisi Derg, 2020, 28(1): 213-214.
[DOI]
|
| [9] |
BELL P, DEPAEPE S, MOORE L. An unusual case of acute cardiac tamponade caused by a cardiac hemangioma[J]. Am J Emerg Med, 2021, 47: 327.e1-327.e2.
[DOI]
|
| [10] |
DENG Y D, YAN R F, LIU R S, et al. Primary cardiac epithelioid haemangioendothelioma[J]. Eur Heart J, 2021, 42(15): 1532.
[DOI]
|
| [11] |
RODRÍGUEZ BANDERA A I, SEBARATNAM D F, WARGON O, et al. Infantile hemangioma. Part 1: epidemiology, pathogenesis, clinical presentation and assessment[J]. J Am Acad Dermatol, 2021, 85(6): 1379-1392.
[DOI]
|
 2023, Vol. 30
2023, Vol. 30


