2. 上海交通大学附属第一人民医院心内科,上海 200080
2. Department of Cardiology, Shanghai General Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200080, China
心房颤动(房颤)是急性心肌梗死(心梗)后最常见的心律失常并发症之一,发病率为6.8%~21%[1]。新发房颤可增加心肌氧耗,诱发和加重心力衰竭,导致血流动力学不稳定,引起卒中及其他血栓栓塞事件,增加患者的病残率和死亡率。急性心梗可导致心肌坏死、炎症、交感神经过度激活,以及血流动力学障碍,从而增加新发房颤的发生率,但迄今为止急性心梗后房颤的具体发病机制仍未完全阐明,临床上亦缺乏有效的治疗方法[2]。电压门控钠离子通道1.8(NaV1.8)存在于心脏神经节丛(ganglionated plexi, GP)中,与房室传导阻滞及房颤的发生有关,并且与急性心梗患者室颤发生危险降低有关,可能是减少室颤发生的保护性因素,但其对急性心梗后房颤发生的影响尚不清楚[3-4]。A-803467是NaV1.8的特异性、可逆性的阻断剂,本研究构建犬急性心梗模型,通过在GP局部注射A-803467,观察阻断心脏GP的NaV1.8对急性心梗后房颤发生的影响。
1 材料与方法 1.1 实验动物与主要试剂共入选比格犬12只,雌雄不限,体质量15~20 kg,由复旦大学附属中山医院实验动物中心提供。随机分为两组:A-803467组(n=6),心梗后于4个主要GP表面多点注射A-803467(1 μmol/0.5 mL);对照组(n=6),心梗后于4个主要GP表面多点注射A-803467的溶剂DMSO(1 μmol/0.5 mL)。A-803467,5-(4-Chlorophenyl)-N-(3, 5-dimethoxyphenyl)-2-furancarboxamide,购自美国Target Mol公司(T2024),相对分子质量为357.8,溶解于DMSO。配制成浓度为2 mmol/L的溶液,以1 mL微量注射器(Hamilton公司)于每个脂肪垫中注射0.5 mL,即1 μmol。
1.2 急性心梗模型构建术前禁食8 h,肌肉注射甲苯噻嗪(2.2 mg/kg)和氯胺酮(30 mg/kg),并以1%~2%异氟烷/O2维持麻醉。气管插管,接呼吸机正压通气。分离右侧股动静脉,分别置入6F动静脉鞘管。使用自制针状电极插入四肢皮下,持续监测体表心电图(Ⅱ、Ⅲ、aVR导联)。沿胸骨正中打开胸腔,剪开心包,缝制心包吊床,用4-0无损伤缝合线将双极起搏电极头端缝于左、右心房及左、右心室游离壁。充分暴露心脏前壁和侧壁,分离冠状动脉左前降支(LAD)近中段,以丝线在第一对角支与第二对角支之间结扎LAD。心电图出现持续性ST段抬高、R波振幅降低、病理性Q波,证实发生心梗。
1.3 确认GP位置右前神经节丛(ARGP)位于右肺静脉与右心房之间的窦房结脂肪垫内,右下神经节丛(IRGP)位于下腔静脉和左心房下部之间的房室结脂肪垫内,左上神经节丛(SLGP)位于左上肺静脉和左心房上部之间的脂肪垫内,左下神经节丛(ILGP)位于左下肺静脉和左心房下部之间的脂肪垫内。放置双极电极(West Chester公司,美国)于心脏脂肪垫表面,接Grass神经刺激仪(Astro-Med公司,美国),发放50 ms高频电刺激(20 Hz,0.1 ms,方波)。刺激GP可引起心率下降、窦性停搏或房室传导明显延缓。
1.4 电生理检查观测用药前及用药后30 min、60 min及90 min,两组间电生理参数的变化情况。体表心电图及电生理信号通过Bard Lab-system电生理仪记录和分析,滤波设置为0.05~500 Hz。窦性心率(sinus rate,SR)定义为窦性心律时连续20次心跳的平均R-R间期对应的心率。采用S1S2程序刺激法测定心房有效不应期(atrial effective refractory period, AERP)。先进行S1S1刺激,S1S1刺激周长为400 ms,刺激电压为2倍舒张期阈值。然后在心房舒张早期进行1次程序早搏S2刺激,S1S2起步间期为200 ms,S1∶S2为8∶1,以10 ms步长递减,并递增刺激重复验证。程序早搏刺激未引起心房应激的最长S1S2间期即为AERP。分别于左、右心房游离壁测量左心房有效不应期(LAERP)和右心房有效不应期(RAERP)。心房易损窗口(window of vulnerability, WOV)定义为能诱发房颤的最长的S1S2间期与最短的S1S2间期的差值,即能够引发房颤的程序刺激范围。计算心房累计易损窗口(the cumulative window of vulnerability, ΣWOV),其定义为左、右心房WOV的总和,用来评价心房颤动的诱发性。计算S1S2刺激后发作房颤的持续时长,统计3次取平均值。
用Grass神经刺激仪于ARGP行电压递增式高频电刺激30~50 s,刺激参数设为频率20 Hz,脉宽0.1 ms,起始电压为1 V,每级增加0.5 V,刺激终点为发生房颤或心脏停搏。在基础状态时及用药后10 min,记录伴随刺激电压增加SR的变化情况。
1.5 统计学处理采用SPSS 21.0软件进行统计分析,结果以x±s表示。用药前及用药后30 min、60 min、90 min,两组间SR、AERP、房颤持续时长及心房ΣWOV的比较采用重复测量资料的方差分析,采用Tukey检验对两组间每个时间点的SR、AERP、房颤持续时长及心房ΣWOV进行两两比较。伴随刺激电压增加,两组间SR的比较采用重复测量资料的方差分析,采用Tukey检验对两组间每个刺激电压水平时的SR进行两两比较。检验水准(ɑ)为0.05。
2 结果 2.1 A-803467对SR的影响急性心梗后,两组间的SR较基线状态下增快。在GP局部注射A-803467后30 min、60 min、90 min,SR进一步增快;但在对照组却没有观察到类似的心率增快效应(P<0.05,图 1)。
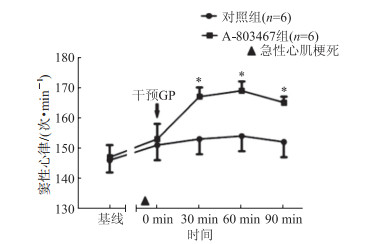
|
| 图 1 急性心梗后两组间窦性心率变化情况 *P<0.05与对照组相比。 |
心梗后,左右心房的ERP较前缩短。在GP局部注射A-803467后30 min、60 min、90 min,左、右心房ERP水平明显短于对照组(P<0.05,图 2)。
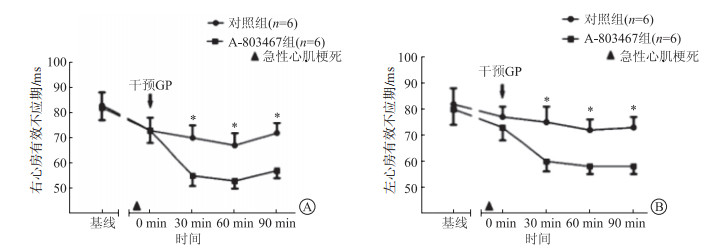
|
| 图 2 急性心梗后两组间ERP变化情况 A:右心房有效不应期;B:左心房有效不应期。*P<0.05与A-803467组相比。 |
心梗后,两组间的心房ΣWOV较前增宽。在GP局部注射A-803467后30 min、60 min、90 min,心房ΣWOV水平明显高于对照组(P<0.05,图 3)。由此可见,A-803467可显著提高心梗后房颤的诱发性。

|
| 图 3 急性心梗后两组间心房ΣWOV变化情况 A:采用S1S2程序刺激计算心房ΣWOV示例;B:在GP局部注射A-803467后30 min、60 min、90 min的心房ΣWOV水平。*P<0.05与对照组相比。 |
本研究统计了房颤诱发后的持续时长,在GP局部注射A-803467后30 min、60 min、90 min,房颤持续时长显著久于对照组(P<0.05,表 1)。
| 时间/s | 对照组(n=6) | A-803467组(n=6) |
| 心梗后即刻 | 6.4±1.6 | 5.8±1.1 |
| 心梗后30 min | 7.1±1.4 | 20.6±3.5* |
| 心梗后60 min | 8.1±1.5 | 17.2±2.8* |
| 心梗后90 min | 7.9±1.3 | 16.2±1.5* |
| *P<0.05与对照组相比。 | ||
于ARGP行高频电刺激可以导致SR的下降,伴随刺激电压的增加,SR可进行性下降。伴随刺激电压增加,对照组的SR几乎线性地进行性下降;然而在A-803467组SR下降趋势明显变缓(P交互<0.001, 图 4)。

|
| 图 4 A-803467局部注射对ARGP功能的影响 |
新发房颤的发生可延长急性心梗患者平均住院时长,增加卒中、心力衰竭及死亡的发生率。与没有房颤及既往发生房颤的患者相比,急性心梗后30 d内的新发房颤是患者心血管死亡、全因死亡、心力衰竭再入院率及发生缺血性卒中的风险显著增加的独立危险因素[5-6],但迄今为止急性心梗后房颤的发生机制尚不清楚,影响其治疗策略的制定及优化。
本研究首次探讨了NaV1.8在急性心梗后房颤发生中的作用。SCN10A位于人类染色体3p21-22区域,编码NaV1.8通道的α亚基。NaV1.8通道为河豚毒素(TTX)非敏感型通道,既往研究[4]认为主要存在于背根神经节的小直径外周感觉神经元及无髓鞘的神经纤维中,在痛觉神经纤维的动作电位传导中起重要作用,而近期研究[7-9]发现,NaV1.8在心脏GP的神经元中表达,而在心肌中检测不到或只有极少量表达,与心脏传导、房性及室性心律失常的发生有关。课题组既往研究[10]发现,在犬急性心梗模型的心脏GP中可检测到SCN10A/NaV1.8的表达,但在心肌中检测不到;阻断GP的NaV1.8可缩短心室ERP及心室颤动阈值,增加室性心律失常的发生,提示NaV1.8可能发挥减少急性心梗后室性心律失常发生的保护性作用,其机制可能与调控心脏GP的功能有关。本研究则发现,局部注射A-803467阻断心脏GP的NaV1.8可提高急性心梗后房颤的诱发性。由此可见,在急性心梗后阻断心脏GP的NaV1.8可同时增加房性及室性心律失常的发生,而NaV1.8可能兼有减少急性心梗后房性及室性心律失常发生的保护性作用,其机制可能与调控心脏GP的功能有关。
本研究结果与课题组之前的研究结果有所不同,反映了心脏GP在是否心肌缺血的状态下功能不同。利用迷走神经刺激诱发的犬急性房颤模型,课题组曾发现局部注射A-803467阻断心脏GP的NaV1.8可抑制迷走神经刺激对心脏房室传导和房颤诱发性的影响,提示NaV1.8可调节心脏传导及房颤诱发性[11-12]。交感神经纤维与副交感神经纤维共存于心脏GP中,但主要为副交感成分。在无心肌缺血时,副交感神经过度兴奋可缩短肺静脉肌袖细胞的ERP和兴奋波长,缩短心房肌的ERP和动作电位时程,增加不应期离散度,从而诱发房颤。所以,此类患者行心脏GP消融可作为射频消融治疗房颤的补充手段,可提高单纯行肺静脉电隔离术治疗房颤的成功率[13]。但是,心梗后存在自主神经重构现象,表现为交感神经的再生和过度再生,而交感神经兴奋性增高可导致AERP缩短,是房性心动过速、房颤等房性心律失常发生的重要诱发因素,而迷走神经可以拮抗交感神经的作用[14]。另外,心梗后GP内交感神经成分功能增强,副交感神经成分功能减弱,而这种功能失衡可以导致心律失常的发生及维持[15]。研究[16-17]表明,单纯的心脏GP消融可以增加房性及室性心律失常的发生,并且可以增加犬急性心梗模型中室性心律失常的发生。
综上所述,本研究利用犬急性心梗模型,发现局部注射A-803467阻断心脏GP的NaV1.8可提高急性心梗后房颤的诱发性,SCN10A/NaV1.8可调控急性心梗后房颤的发生,其作用机制可能与调控心脏GP的功能有关。在后续研究中,将对心脏GP的NaV1.8调控心肌电生理特性及GP功能的确切信号通路机制进行系统性的探索。本研究为探究心梗后房颤的机制及防治提供了新的思路,并且将为其预防、基因治疗和新药研发等提供重要参考。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
SCHMITT J, DURAY G, GERSH B J, et al. Atrial fibrillation in acute myocardial infarction: a systematic review of the incidence, clinical features and prognostic implications[J]. Eur Heart J, 2009, 30(9): 1038-1045.
[DOI]
|
| [2] |
BIKOU O, KHO C, ISHIKAWA K. Atrial stretch and arrhythmia after myocardial infarction[J]. Aging (Albany NY), 2018, 11(1): 11-12.
|
| [3] |
FODDHA H, BOUZIDI N, FODDHA A, et al. Single nucleotide polymorphisms of SCN5A and SCN10A genes increase the risk of ventricular arrhythmias during myocardial infarction[J]. Adv Clin Exp Med, 2020, 29(4): 423-429.
[DOI]
|
| [4] |
CHAMBERS J C, ZHAO J, TERRACCIANO C M, et al. Genetic variation in SCN10A influences cardiac conduction[J]. Nat Genet, 2010, 42(2): 149-152.
[DOI]
|
| [5] |
FAUCHIER L, BISSON A, BODIN A, et al. Outcomes in patients with acute myocardial infarction and new atrial fibrillation: a nationwide analysis[J]. Clin Res Cardiol, 2021, 110(9): 1431-1438.
[DOI]
|
| [6] |
OBAYASHI Y, SHIOMI H, MORIMOTO T, et al. Newly diagnosed atrial fibrillation in acute myocardial infarction[J]. J Am Heart Assoc, 2021, 10(18): e021417.
[DOI]
|
| [7] |
CASINI S, MARCHAL G A, KAWASAKI M, et al. Absence of functional Nav1.8 channels in non-diseased atrial and ventricular cardiomyocytes[J]. Cardiovasc Drugs Ther, 2019, 33(6): 649-660.
[DOI]
|
| [8] |
HAN C Y, HUANG J Y, WAXMAN S G. Sodium channel Nav1.8: emerging links to human disease[J]. Neurology, 2016, 86(5): 473-483.
[DOI]
|
| [9] |
HAYASHI K, TERAMOTO R, NOMURA A, et al. Impact of functional studies on exome sequence variant interpretation in early-onset cardiac conduction system diseases[J]. Cardiovasc Res, 2020, 116(13): 2116-2130.
[DOI]
|
| [10] |
QI B Z, DAI S M, SONG Y, et al. Blockade of NaV1.8 increases the susceptibility to ventricular arrhythmias during acute myocardial infarction[J]. Front Cardiovasc Med, 2021, 8: 708279.
[DOI]
|
| [11] |
QI B Z, WEI Y, CHEN S W, et al. Nav1.8 channels in ganglionated plexi modulate atrial fibrillation inducibility[J]. Cardiovasc Res, 2014, 102(3): 480-486.
[DOI]
|
| [12] |
齐保振, 刘少稳, 魏勇, 等. 阻断钠离子通道1.8对心脏神经丛功能的影响[J]. 中国心脏起搏与心电生理杂志, 2016, 30(3): 246-248. QI B Z, LIU S W, WEI Y, et al. The effects of blocking Nav1.8 channels on the cardiac ganglionated plexi function[J]. Chin J Cardiac Pacing Electrophysiol, 2016, 30(3): 246-248. |
| [13] |
PAPPONE C, SANTINELLI V, MANGUSO F, et al. Pulmonary vein denervation enhances long-term benefit after circumferential ablation for paroxysmal atrial fibrillation[J]. Circulation, 2004, 109(3): 327-334.
[DOI]
|
| [14] |
ZHU C, HANNA P, RAJENDRAN P S, et al. Neuromodulation for ventricular tachycardia and atrial fibrillation: a clinical scenario-based review[J]. JACC Clin Electrophysiol, 2019, 5(8): 881-896.
[DOI]
|
| [15] |
VAN WEPEREN V Y H, VOS M A, AJIJOLA O A. Autonomic modulation of ventricular electrical activity: recent developments and clinical implications[J]. Clin Auton Res, 2021, 31(6): 659-676.
[DOI]
|
| [16] |
MAO J, YIN X D, ZHANG Y, et al. Ablation of epicardial ganglionated plexi increases atrial vulnerability to arrhythmias in dogs[J]. Circ Arrhythm Electrophysiol, 2014, 7(4): 711-717.
[DOI]
|
| [17] |
HE B, LU Z B, HE W B, et al. Effects of ganglionated plexi ablation on ventricular electrophysiological properties in normal hearts and after acute myocardial ischemia[J]. Int J Cardiol, 2013, 168(1): 86-93.
[DOI]
|
 2023, Vol. 30
2023, Vol. 30


