2. 复旦大学附属中山医院风湿免疫科,上海 200032;
3. 复旦大学附属中山医院心内科,上海 200032;
4. 复旦大学附属中山医院普外科,上海 200032;
5. 复旦大学附属中山医院呼吸科,上海 200032;
6. 上海市心血管病研究所中心实验室,上海 200032;
7. 复旦大学附属中山医院放疗科,上海 200032;
8. 复旦大学附属中山医院药剂科,上海 200032;
9. 复旦大学附属中山医院肝肿瘤外科,上海 200032;
10. 复旦大学附属中山医院心脏超声诊断科,上海 200032;
11. 国家放射与治疗临床医学研究中心,上海 200032;
12. 上海市心血管病研究所,上海 200032;
13. 上海市影像医学研究所,上海 200032
2. Department of Rheumatology and Immunology, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
3. Department of Cardiology, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
4. Department of General Surgery, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
5. Department of Respiratory Medicine, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
6. Central Laboratory of Shanghai Institute of Cardiovascular Diseases, Shanghai 200032, China;
7. Department of Radiotherapy, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
8. Department of Pharmacy, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
9. Department of Hepatic Oncology, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
10. Department of Cardiac Ultrasound, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
11. National Clinical Study Center for Radiology and Therapy, Shanghai 200032, China;
12. Shanghai Institute of Cardiovascular Diseases, Shanghai 200032, China;
13. Shanghai Institute of Imaging Medicine, Shanghai 200032, China
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)现已应用于多种恶性肿瘤的治疗,包括黑素瘤、肺癌、肾细胞癌、胃癌、结直肠癌、肝癌、宫颈癌、头颈部鳞状细胞癌、默克尔细胞癌、皮肤鳞状细胞癌和三阴性乳腺癌等,并且其适应证的拓展仍在不断探索中。目前共有16款ICIs在国内上市,根据治疗靶点不同,可分为3类,包括(1)程序性细胞死亡蛋白-1(programmed cell death protein-1,PD-1)抑制剂:帕博利珠单抗(pembrolizumab)、纳武利尤单抗(nivolumab)、特瑞普利单抗(toripalimab)、信迪利单抗(sintilimab)、卡瑞利珠单抗(camrelizumab)、替雷利珠单抗(tislelizumab)、派安普利单抗(penpulimab)、赛帕利单抗(zimberelimab)、斯鲁利单抗(serplulimab)和普特利单抗(pucotenlimab);(2)程序性细胞死亡蛋白-1配体(programmed death-ligand 1,PD-L1)抑制剂:度伐利尤单抗(durvalumab)、阿替利珠单抗(atezolizumab)、恩沃利单抗(envafolimab)和舒格利单抗(sugemalimab);(3)细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)抑制剂:伊匹木单抗(ipilimumab)。此外,PD-1/CTLA-4双特异性抗体卡度尼利单抗(cadonilimab)已于2022年6月29日获得国家药品监督管理局批准上市,用于治疗复发或转移性宫颈癌,是首个国内获批的PD-1/CTLA-4双特异性抗体类ICIs。
ICIs治疗可导致轻重程度不一的免疫相关不良事件(immune-related adverse events,irAEs),广泛影响全身各个器官[1]。最常见的irAEs为疲劳、瘙痒、腹泻和皮疹[2]。尽管大部分irAEs为轻度或中度,无需特殊治疗,停药后可缓解,然而一些严重的irAEs,如ICIs相关肺炎、ICIs相关心肌炎、ICIs相关神经毒性和致死性腹泻等,不仅会阻碍治疗进而影响治疗效果,还可能直接导致患者死亡。其中,ICIs相关心肌炎的发生率虽低,却是irAEs中死亡率最高的不良事件[3-5]。因此,临床治疗中需要严密关注这一少见但严重的不良事件,并提升对ICIs相关心肌炎的识别和处理能力。
现国内外已制定多个指南或共识,如《免疫检查点抑制剂相关心肌炎监测与管理中国专家共识(2020版)》、《2022 ESC肿瘤心脏病学指南》等[6-7],对ICIs相关心肌炎的临床管理进行了系统性指导,足见ICIs相关心肌炎在临床实践中的关注度日益提升。但ICIs相关心肌炎的发生机制及诊疗路径尚处于探索阶段,不断有新的研究成果和临床经验涌现。因此,本临床诊疗实施建议注重实操性,聚焦关键临床问题,参考国内外相关共识或指南和新近发表的循证证据,并结合复旦大学附属中山医院肿瘤心脏病团队实际临床经验,为ICIs相关心肌炎的诊疗提供具有实践性的指导意见和建议,供心血管科和肿瘤相关科室临床医师参考。
1 ICIs相关心肌炎的流行病学ICIs相关心肌炎的发生率为0.06%~3.80%[3, 8-10],而死亡率则高达39.7%~66.0%[4, 8]。由此可见,ICIs相关心肌炎发生率虽低,但死亡率较高,且2种ICIs联合治疗时的ICIs相关心肌炎死亡率(66%)比ICIs单药治疗(44%)更高[8]。严重心肌炎,即常见不良事件评价标准(CTCAE 5.0)中3级及以上的心肌炎,发生率为0.09%[8, 11]。PD-1抑制剂单药、PD-L1抑制剂单药、CTLA-4抑制剂单药、PD-1抑制剂联合CTLA-4抑制剂、PD-L1抑制剂联合CTLA-4抑制剂治疗时,ICIs相关心肌炎的发生率分别为0.5%、2.4%、3.3%、2.4%和1%[5]。另一项研究[12]中,PD-1抑制剂单药、CTLA-4抑制剂单药、CTLA-4抑制剂联合PD-1抑制剂或PD-L1的ICIs相关心肌炎的发生率分别为0.41%、0.07%、1.30%。
2 ICIs相关心肌炎的危险因素及预防措施问题1:ICIs相关心肌炎的高危人群有哪些?
推荐意见1 以下人群发生ICIs相关心肌炎的风险可能更高:ICIs联合治疗(2种ICIs联合、ICIs联合化疗或抗血管生成药物);合并糖尿病、睡眠呼吸暂停或桥本甲状腺炎;有基础心脏疾病(如心力衰竭和急性冠脉综合征病史);体质量指数较高或高龄患者等。
主要证据
心肌炎发生风险与ICIs联合使用显著相关。相较于ICIs单药治疗,ICIs联合治疗(2种ICIs治疗、ICIs联合化疗和ICIs联合抗血管生成药物)导致的心肌炎发生率更高。一项纳入51项临床研究共13 646例患者的荟萃分析[13]显示,与ICIs单药治疗相比,ICIs联合治疗时的心血管irAEs(包括心肌炎)发生率更高(ICIs单药治疗irAEs发生率为3.1%;PD-1抑制剂联合CTLA-4抑制剂治疗irAEs发生率为5.8%;ICIs联合化疗irAEs发生率为3.7%)。一项研究[14]分析了美国食品和药品管理局(FDA)临床安全数据库的不良事件报告,发现在所有类型癌症患者中,与ICIs单药治疗[伊匹木单抗:比值比(OR)=6.5(95%CI 4.2~10.0);帕博利珠单抗:OR=24.1(95%CI 19.7~29.4);纳武利尤单抗:OR=20.1(95%CI 17.1~23.7)]相比,ICIs联合治疗与心肌炎的关联性更强[(伊匹木单抗联合纳武利尤单抗OR=46.2(95%CI 38.2~55.9);伊匹木单抗联合帕博利珠单抗OR=45.5(95%CI 16.8~122.7);帕博利珠单抗联合阿昔替尼OR=36.9(95%CI 11.8~115.9);阿维单抗联合阿昔替尼OR=55.6(95%CI 13.4~222.3)]。另一项研究[11]分析了药物安全数据库中ICIs相关心肌炎的发生率,结果显示,与纳武利尤单抗相比,伊匹木单抗联合纳武利尤单抗的相关心肌炎发生率更高(0.06% vs 0.27%,P<0.001),且更严重。
另外,合并糖尿病、睡眠呼吸暂停、桥本甲状腺炎、有心力衰竭病史或急性冠脉综合征病史的患者,发生ICIs相关心肌炎的风险也更高[5, 15]。一项回顾性、多中心、真实世界、病例对照研究[5],纳入35例发生ICIs相关心肌炎患者作为治疗组,105例接受ICIs治疗但未发生心肌炎的患者作为对照组。结果显示,与对照组相比,心肌炎病例组的体质量指数[(29.0±8.4)kg/m2 vs (26.0±6.0)kg/m2,P=0.02]更高,患糖尿病(34% vs 13%,P=0.01)和睡眠呼吸暂停(14% vs 3.8%,P=0.04)的患者比例更高。一项队列研究[15]的风险预测模型结果显示,有心力衰竭病史[风险比(HR)=5.2(95%CI 1.4~18.7),P=0.01]、急性冠脉综合征病史[HR=4.06(95%CI 1.15~14.3),P=0.03]、合并桥本甲状腺炎[HR=15.9(95%CI 1.9~132.9),P=0.01]和年龄大于80岁[每增加1岁的HR=1.07(95%CI 1.01~1.14),P=0.02]的患者,发生ICIs相关心肌炎的风险更高。另一项评估ICIs相关心肌炎风险因素的研究[16]显示,年龄大于75岁[OR=7.61(95%CI 4.29~13.50),P<0.001],以及同时使用纳武利尤单抗和伊匹木单抗治疗[OR=1.93(95%CI 1.19~3.12),P=0.08]的女性患者[OR=1.92(95%CI 1.24~2.87),P=0.04],发生ICIs相关心肌炎的风险更高。因此,对ICIs相关心肌炎高风险患者,建议进行密切监测,及时发现和治疗ICIs相关心肌炎。
问题2:ICIs治疗前应如何管理患者以预防ICIs相关心肌炎?
推荐意见2-1 在ICIs治疗前推荐对患者进行基线评估,包括家族史、个人史、症状、体征、心肌损伤标志物、D-二聚体、心电图、超声心动图等。
推荐意见2-2 若患者存在心血管疾病史或基线评估结果异常,需请心血管科医师会诊协助评估,并对患者进行规范管理。患者合并自身免疫性疾病虽然不是ICIs治疗的绝对禁忌证,但合并自身免疫性疾病患者在使用ICIs后,会增加自身免疫性疾病活动和(或)发生其他irAEs的机会;与ICIs开始前没有接受免疫抑制治疗的患者相比,接受免疫抑制治疗患者的总体生存期更短。若患者在4周内发生急性冠脉综合征、急性失代偿性心力衰竭、慢性心力衰竭心功能Ⅳ级或急性肺栓塞,建议经规范治疗且病情稳定后再开始ICIs治疗,需密切关注其病情变化。
推荐意见2-3 不推荐常规使用糖皮质激素预防ICIs相关免疫不良反应,除非患者存在特殊适应证(如曾有输液反应或同步化疗)。
推荐意见2-4 推荐对计划接受ICIs治疗的患者进行药物不良反应教育,以便患者在发生irAEs时能自我识别并及时就医。
主要证据
在ICIs治疗前对患者进行基线评估有利于在ICIs治疗过程中监测患者的病情进展和变化,并早期识别和诊断ICIs相关心肌炎。发生ICIs相关心肌炎的患者在接受ICIs治疗后心肌肌钙蛋白(cardiac troponin,cTn)T/I,肌酸激酶(creatine kinase,CK),肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB),利钠肽水平均有不同程度升高[17-19]。此外,心肌损伤标志物[包括cTn、CK、CK-MB和肌红蛋白(myoglobin,Mb)]异常往往早于临床症状的发生,且与疾病严重程度有关。因此,建议在开始ICIs治疗前收集患者的基础病史(个人史和家族史),并进行全面的体格检查以评估是否存在心力衰竭或心血管疾病的症状或体征,同时完善心肌损伤标志物(评估亚临床型心肌损伤并为后续监测提供基线参照)、利钠肽、D-二聚体、心电图(评估是否存在心律失常和心脏传导系统疾病,为后续监测提供基线参照)和超声心动图(评估结构性心脏病并建立双心室功能和血流动力学基线参照)等检查[20-22]。若患者存在心血管疾病史或基线结果异常,需心血管科医师协助评估及规范管理。
合并自身免疫性疾病的患者,在接受CTLA-4抑制剂治疗和(或)PD-1或PD-L1抑制剂治疗后均有自身免疫性疾病恶化案例发生[6, 23-24]。一项回顾性多中心研究[25]发现,在接受PD-1抑制剂(纳武利尤单抗或帕博利珠单抗)联合伊匹木单抗治疗且合并自身免疫性疾病的55例晚期黑素瘤患者中,18例(33%)患者发生了自身免疫性疾病的恶化,包括类风湿性关节炎(4/7)、银屑病(3/6)、炎症性肠病(5/10)、干燥综合征(1/1)和多肌痛(1/1)等,8例(44%)患者因此暂停ICIs治疗;与未进行免疫抑制治疗的患者相比,接受免疫抑制治疗的患者发生自身免疫性疾病恶化的可能性更高(OR=4.59,P=0.03);接受ICIs治疗前未曾接受免疫抑制治疗的自身免疫性疾病患者,其中位生存期(median overall survival, mOS)比接受免疫抑制的患者更长(31个月vs 11个月,P=0.005)。另一项国际、多中心、回顾性研究[26]也有类似发现,除银屑病和银屑病关节炎、类风湿性关节炎、炎症性肠病复发频率较高以外,14%(1/7)的红斑狼疮患者在ICIs治疗后发生了自身免疫性疾病恶化;79例(71%)肿瘤患者在接受ICIs治疗后发生了自身免疫性疾病恶化和(或)其他irAEs,其中47例(42%)患者在接受ICIs治疗后发生irAEs,53例(47%)患者在ICIs治疗后自身免疫性疾病发作,但53例患者中只有24例(21%)患者因此暂停ICIs治疗;与ICIs开始前没有接受免疫抑制治疗的患者相比,接受免疫抑制治疗患者的中位无进展生存期(median progression free survival,mPFS)更短(3.8个月vs 12个月,P=0.006)。
此外,自身免疫性疾病的活动度可能会影响irAEs的发生[27]。一项回顾性研究[28]发现,处于自身免疫性疾病非活动期的肿瘤患者接受PD-L1抑制剂治疗后,发生任意等级irAEs和G3/G4级irAEs的发生率分别为64.3%和8.6%,而处于活动期的患者分别为73.3%和13.3%;自身免疫性疾病非活动期和活动期患者的ORR分别为38.1%(95%CI 24.4~56.6)和50%(95%CI 23.0~76.9),mPFS分别为14.4个月(95%CI 5.3~17.1)和6.8个月(95%CI 5.1~9.4),mOS为15.7个月(95%CI 10.3~24.3)和9.8个月(95%CI 5.8~24.6)。Menzies等[29]也有类似发现,与自身免疫性疾病非临床活动期的晚期黑素瘤患者相比,处于自身免疫性疾病临床活动期的患者发生自身免疫性疾病恶化的患者比例更高(60% vs 30%,P=0.039)。因此,自身免疫性疾病处于缓解状态或低疾病活动度的患者若充分知情,且肿瘤科和风湿免疫科医师意见统一,可考虑ICIs的治疗,但需密切监测随访,同时建议根据患者自身免疫性疾病的活动情况调整糖皮质激素使用[6, 30]。
预防性应用糖皮质激素可能降低ICIs药物的抗肿瘤疗效[31],且可能影响患者预后。一项回顾性、多中心、观察性研究[31]分析了640例采用PD-1抑制剂或PD-L1抑制剂初治的晚期非小细胞肺癌患者,其中90例(14%)患者在接受PD-1抑制剂或PD-L1抑制剂单药治疗的同时,每日接受≥10 mg泼尼松,多因素回归分析显示,基线使用糖皮质激素与无进展生存期(progression free survival,PFS;HR=1.3,P=0.03)和总生存期(overall survival,OS;HR=1.7,P<0.001)下降有关。因此,不推荐常规使用糖皮质激素预防ICIs相关免疫不良反应,除非患者存在特殊适应证(如曾有输液反应或同时化疗)[6]。
因ICIs相关心肌炎的致死风险高,推荐对计划接受ICIs治疗的患者进行药物不良反应教育,包括可能出现的irAEs及其临床特征,以便患者在接受ICIs治疗后自我识别irAEs并及时就诊[6]。
问题3:ICIs治疗过程中如何监测ICIs相关心肌炎的发生?
推荐意见3-1 推荐在接受ICIs首剂治疗7 d内随访患者的症状和体征,复查cTn和心电图,若与基线相似,之后每次ICIs用药前检查cTn和心电图等;ICIs用药3个月内密切随访患者的症状和体征,推荐ICIs双周治疗的患者在第2~9个治疗周期内、ICIs 3周治疗患者在第2~6个治疗周期内,每次用药前接受症状和体征检查,复查心电图和cTn,可考虑联合监测利钠肽、Mb或CK;3个月后建议每次用药前监测患者症状和体征,复查心电图,有可疑指征时检查心肌损伤标志物、超声心动图等。
推荐意见3-2 ICIs治疗过程中推荐通过电话、门诊或互联网诊疗平台等多种手段定期监测患者的症状、体征、心电图和cTn等。
主要证据
在接受ICIs治疗后,部分患者的心肌损伤标志物水平可能会发生变化,这些指标变化反映ICIs可能会造成急性和慢性心肌炎损伤[32]。一项回顾性、真实世界、队列研究纳入204例接受ICIs治疗的患者(治疗组)和205例接受传统化疗的患者(对照组)。结果显示,ICIs治疗组患者的平均cTn和利钠肽,相比治疗前基线水平显著升高,并在1个月左右达到峰值[cTn:(0.008 1±0.010 3)μg/L vs (0.026 7±0.010 2)μg/L,P=0.039;利钠肽:(104.0±174.6)μg/L vs (310.86±2 730.58)μg/L]后逐渐下降,在治疗第3个月或第4个月后,心肌损伤标志物水平再次升高;ICIs治疗组心肌炎发生率为1.47%(3/204),对照组患者中无心肌炎发生,且与对照组相比,ICIs治疗组新发生的心电图ST-T异常率(38/180 vs 16/178,P=0.001)、利钠肽(10/187 vs 4/201,P=0.076)和cTn(9/203 vs 2/201,P=0.028)水平异常发生率更高(超过正常值上限至少2倍)[32]。此外,治疗早期常规cTn监测可能有助于预测接受ICIs治疗患者的预后和死亡风险[33-34]。一项回顾性单中心研究[34]分析了23例在ICIs治疗后发生cTn升高的严重心肌炎和亚临床心肌炎患者发现,高水平cTn(P=0.016)、CK(P=0.013)和CK-MB(P=0.034)与死亡率增加有关;定期监测组对比未定期每周监测cTn组,患者在就诊时cTn水平更低(P=0.022)、开始糖皮质激素治疗的时间更短(P=0.053)。因此,推荐对接受ICIs治疗的患者采取主动监测策略,包括对患者进行定期随访和监测。
多个研究[5, 11, 14, 35-36]显示,ICIs相关心肌炎发生的中位时间为用药后17~65 d,一项系统性综述汇总了2015年至2021年发表的ICIs相关心脏毒性病例报道数据,结果显示,ICIs相关心肌炎的中位发生时间为65 d,约81%的患者在ICIs治疗后的3个月内发生ICIs相关心肌炎[37]。中国人群中,ICIs相关心肌炎发生的中位时间为用药后38 d(2~420 d),且81.2%的患者在第1~2次ICIs用药时发生ICIs相关心肌炎。ICIs治疗期间对患者进行定期监测,有助于早期发现包括ICIs相关心肌炎在内的免疫相关心血管不良事件并提供及时治疗。
3 ICIs相关心肌炎的诊断和鉴别诊断问题4:哪些症状和体征可能提示心肌炎?
推荐意见4 患者出现以下情况需警惕心肌炎可能:无法用其他原因解释的新发症状或体征,如心悸、胸痛、急性或慢性心力衰竭、心律不齐、心包炎、心包积液等;发生肌炎、重症肌无力、呼吸障碍、肝功能异常、甲状腺功能异常等irAEs;相对基线的心肌损伤标志物水平升高,如cTn、Mb、CK及CK-MB升高等;心电图出现新发异常,如各种类型传导阻滞、ST-T改变、QRS波群增宽或心动过速等。
主要证据
ICIs引起的心肌炎临床症状表现:无症状(无任何心血管症状)、轻微症状、明显症状和暴发性症状。ICIs相关心肌炎常见症状包括呼吸短促、心悸、胸痛、水肿和乏力等[37-39],典型心肌炎综合征还包括心包炎、心包积液等表现。一项分析ICIs相关心脏毒性的系统性综述[37]汇总了2015年至2021年发表的病例报道数据,结果显示,呼吸短促、心悸以及充血性心力衰竭的症状(如水肿、疲劳、虚弱等)在发生ICIs相关心肌炎的患者中最为常见。约半数的ICIs相关心肌炎患者会合并其他irAEs[5],其中合并肌炎的患者比例约为25%,合并重症肌无力的患者比例为10%[8]。明显症状心肌炎患者可能伴发肌炎、呼吸功能障碍、肝功能异常和甲状腺功能异常等其他irAEs;暴发性症状心肌炎患者起病急骤,病情进展迅速,常伴有血流动力学异常、心律失常如传导障碍或重症肌无力等其他症状[21, 39-40]。
除上述临床表现外,心肌损伤标志物与基线相比异常升高(如cTn、Mb、CK及CK-MB升高等)和心电图出现新发异常(如各种类型传导阻滞、ST-T改变、QRS波群增宽或心动过速等)均提示可能发生心肌炎[41],此时建议患者暂缓ICIs治疗,直至排除心肌炎。
问题5:如何进行ICIs相关心肌炎的诊断?
推荐意见5-1 当患者疑似发生ICIs相关心肌炎时,建议立即进行心血管科会诊,除详细询问症状和行体征检查外,推荐完善心电图、超声心动图、心肌损伤标志物(cTn、CK、CK-MB和Mb等)、利钠肽、D-二聚体、天冬氨酸转氨酶、白细胞计数、炎性标志物(红细胞沉降率、C反应蛋白)、甲状腺功能、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、皮质醇水平及可溶性生长刺激表达基因蛋白2(soluble suppression of tumorigenicity 2,sST2,可选)等检查。若上述项目结果较基线未变化,不推荐进一步行心脏磁共振(magnetic resonance imaging,MRI)检查。若上述结果出现异常,建议进行心血管科会诊。具体诊断流程参考图 1。
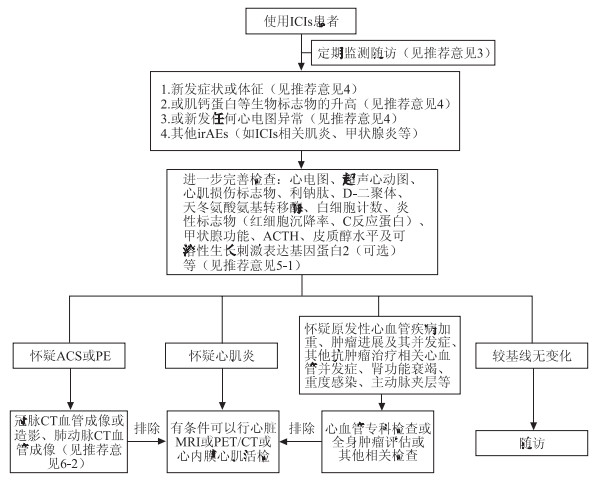
|
| 图 1 ICIs相关心肌炎的诊断流程 ACS:急性冠脉综合征;PE:肺栓塞。 |
推荐意见5-2 心脏MRI是诊断心肌炎的首选影像学方法,有条件可以行心脏MRI检查,必要时行心内膜心肌活检。
主要证据
心肌损伤标志物可以用于ICIs相关心肌炎的初步诊断。一项多中心登记数据库研究[5]发现,在发生ICIs相关心肌炎的患者中,94%的患者肌钙蛋白I(cardiac troponin I,cTnI)升高,约70%发生利钠肽升高。除上述指标外,部分患者存在cTn正常但肌酐升高[42],或sST2和D-二聚体升高的情况[43]。因此,cTn、CK、CK-MB、利钠肽和D-二聚体等均可考虑用于ICIs相关心肌炎诊断[17-19]。若患者同时存在肌炎或检测到CK-MB(或CK)和肌钙蛋白T(cardiac troponin T,cTnT)升高时,推荐复查cTnI[18]。鉴于约半数的ICIs相关心肌炎患者会合并其他irAEs,其中重症心肌炎患者可能伴发肌炎、肝功能异常和甲状腺功能异常等其他irAEs[5, 8],因此,为避免漏诊心肌炎合并其他系统irAEs,建议疑似心肌炎的患者完善ACTH、皮质醇、甲状腺功能等检查,以排除其他irAEs。此外,由于临床也存在以肌炎、肝炎或甲状腺炎作为首发症状就诊的心肌炎患者,为防止心肌炎漏诊,建议对有其他irAEs的患者进一步检查,以排除心肌炎。
心电图可以作为ICIs相关心肌炎的支持诊断。约90%的心肌炎患者会出现心电图异常,其具体表现包括多种类型心律失常(窦性心动过速、心房颤动、房性或室性期前收缩、室上性心动过速、窦性停搏、房室传导阻滞、室内传导延迟或束支传导阻滞、室性心动过速或心室颤动、心脏停搏等)[44-45]、QT间期延长、ST段抬高、T波倒置、R波幅度减低、异常Q波、低电压等,但相对特异性表现为房室传导阻滞[5, 19]。一项探究ICIs相关心肌炎心电图特征的病例对照研究[46],比较了140例ICIs相关心肌炎患者(试验组)和179名患者(对照组)在ICIs治疗前、治疗中、治疗后3个不同时间点的心电图指标,结果显示,相比于患者接受ICIs治疗前的QRS持续时间[(99±20) ms,P=0.001]、对照组ICIs治疗期间的QRS持续时间[(93±19) ms,P<0.001]和心肌炎发生前的QRS持续时间[(97±19) ms,P=0.009],心肌炎发生时患者的QRS持续时间明显延长(110±22)ms。且每延长10 ms,发生主要心脏不良事件的风险增加1.3倍(95%CI 1.07~1.61,P=0.011)。
超声心动图通常是评估心功能的一线影像学手段,一般用于急性或亚急性症状的患者,约50%的ICIs相关心肌炎患者会出现左室射血分数(left ventricular ejection fraction,LVEF)下降,可能出现节段室壁运动异常、弥漫性左室收缩功能减退、心腔扩大或室壁增厚等改变[5],但超声心动图对心肌炎诊断可能不具有特异性,特别是在患者收缩功能相对保留的情况下,其灵敏度较低[47-48]。不过,无论LVEF是否正常,心肌炎患者左心室整体长轴应变(left ventricular longitudinal strain,LVLS)明显下降[49]。三维显像可提升心脏超声的诊断价值[50]。肿瘤治疗导致的心功能损伤患者中,左心室超声心动图三维斑点追踪显像测得的不同左心室段的三维左心室长轴应变(three dimensional left ventricular longitudinal strain,3D-LVLS)平均值与血清高敏感cTnT水平相关,可考虑作为诊断手段[51]。
心脏MRI是诊断心肌炎的首选影像学方法[21],ICIs相关心肌炎的心脏MRI与未接受ICIs治疗的癌症患者具有不同的特征。一项回顾性观察性研究[52]分析了33例ICIs相关心肌炎患者和21例计划接受ICIs治疗的癌症患者(pre-ICIs组)的心脏MRI,结果显示与pre-ICIs组患者相比,ICIs相关心肌炎患者中延迟钆增强发生率更高(82% vs 10%,P<0.001)。
若无法进行心脏MRI,正电子发射计算机断层显像(positron emission tomography/computed tomo-graphy,PET/CT)是一个很好的替代方案[37, 53],且该方法在检测ICIs相关心肌炎时的灵敏度高,尤其是在心肌炎的早期阶段[54-55]。一项单中心回顾性研究[54]分析了11例临床疑似ICIs相关心肌炎的患者,其中9例患者行68Ga-DOTATOC PET/CT检查,8例患者行心脏MRI检查,结果发现,所有行PET/CT检查的患者均提示心肌炎存在,3/8(38%)行心脏MRI的患者提示心肌炎病变存在;此外,在6例心肌炎伴肌炎的患者中,5例PET/CT成像显示骨骼肌处见病理性吸收,提示PET/CT也可用于检测心肌炎并发肌炎。与单独使用PET/CT或心脏MRI相比,同步心脏18氟脱氧葡萄糖PET/MR在评估心肌炎方面可能具有补充价值[56]。
心内膜心肌活检是心肌炎诊断的金标准[41],活检组织病理可见大量T淋巴细胞浸润,存在一定程度纤维化,传导系统也可受累[11, 57]。然而由于活检具有侵入性,所以只有诊断有疑问或对初始治疗没有反应的患者,可考虑进行心肌内膜活检[58]。
问题6:如何进行ICIs相关心肌炎的鉴别诊断?(图 1)
推荐意见6-1 应考虑将ICIs相关心肌炎与其他疾病进行鉴别诊断,包括急性冠状动脉综合征、肺栓塞、原发性心血管疾病加重、肿瘤进展及其并发症、其他抗肿瘤治疗相关心血管并发症、肾功能衰竭、重度感染、主动脉夹层以及其他原因导致的心肌炎等。
推荐意见6-2 建议对患者进行心血管专科检查、全身肿瘤评估或其他检查,以排除已知心血管疾病或非心血管疾病可解释的症状或异常检测结果。鉴别诊断的方法包括但不限于:询问患者家族史和个人患病史、心肌损伤标志物检测、D-二聚体检测、心脏MRI、超声心动图、冠状动脉CT血管成像或造影、肺动脉CT血管成像等。
主要证据
ICIs相关心肌炎的诊断需排除已知心血管疾病或非心血管疾病可解释的症状或异常检测结果。
Veronese等[59]比较了ICIs相关心肌炎和非ICIs相关急性心肌炎的临床表现和特征,纳入分析的88例ICIs相关心肌炎患者中,53例数据来源于病例报告,35例来源于一项观察性研究。443例非ICIs相关急性心肌炎患者数据来源于一项多中心注册数据库。结果显示,ICIs相关心肌炎和非ICIs相关急性心肌炎患者的cTn或CK-MB水平均会上升(病例报告、观察性研究和多中心注册数据库分析研究中cTn或CK-MB水平上升的患者比例分别为97%、94%、99%),但ICIs相关心肌炎患者出现心肌延迟钆增强的比例低于非ICIs相关急性心肌炎患者(病例报告、观察性研究和多中心注册数据库分析研究分别为65%、64%、100%)。因此,可以通过心脏MRI对二者进行鉴别诊断[59]。
ICIs相关心肌炎与病毒性心肌炎的心脏MRI也具有不同特征。一项回顾性观察性研究[52]分析了33例ICIs相关心肌炎患者和85例病毒性心肌炎患者的心脏MRI特征,结果显示,与病毒性心肌炎患者相比,ICIs相关心肌炎患者的延迟钆增强发生率更低(82% vs 100%,P<0.001),且延迟强化更多见于室间隔和中壁层(48% vs 29%,P<0.001;33% vs 2%,P<0.001)。
急性冠状动脉综合征与部分ICIs相关心肌炎在临床表现、心电图以及心肌损伤标志物变化等方面类似,若无法鉴别,需心血管科会诊;若心电图符合ST段抬高型心肌梗死,需进行急诊冠状动脉造影以确诊。
此外,肺栓塞的症状、心电图以及心肌损伤标志物变化等方面也与ICIs相关心肌炎类似,但可以通过监测D-二聚体进行鉴别诊断,若D-二聚体阳性,可根据肺栓塞可能性评分和诊断流程图,结合血气分析、超声心动图、静脉超声结果,必要时行肺动脉CT血管成像检查进行鉴别。
其他原因导致的心功能不全或心力衰竭,包括遗传性心肌病、先天性心脏病、既往心血管疾病进展或服用其他导致心力衰竭的药物或毒素等,这些情况通常利钠肽水平明显升高,cTn无升高或轻微升高,可以通过家族史、个人疾病史和心脏MRI检查进行鉴别诊断。其他原因所致心律失常,包括使用其他抗肿瘤药物、离子紊乱、既往心血管疾病进展、邻近肿瘤压迫等,通常表现为cTn水平无升高,部分患者可能伴利钠肽轻度升高。
此外,可以通过超声心动图排除瓣膜病或其他心肌病(扩张型、肥厚型或限制性)[21]。cTn、CK水平检测和肌电图可以用于排除并发肌炎,特别是联合免疫抑制治疗的患者[58]。
4 ICIs相关心肌炎的临床分型与治疗问题7:ICIs相关心肌炎应如何进行临床分型?
推荐意见7 结合临床表现和辅助检查结果,ICIs相关心肌炎由轻至重可分为亚临床心肌损伤、轻症型ICIs相关心肌炎、重症型ICIs相关心肌炎和危重型ICIs相关心肌炎4种临床分型(表 1)。还可根据糖皮质激素治疗后cTn的变化情况,建议将ICIs相关性心肌炎患者分为激素抵抗型和激素敏感型2种类型。
| 临床分型 | 判断标准 |
| 亚临床心肌损伤 | 以下3条均需符合[6, 20-21, 58, 60-61]: (1)患者日常活动不会引起临床症状; (2)仅表现为cTn轻度升高,但无其他心肌损伤标志物升高; (3)其他辅助检查均无异常。 |
| 轻症型 | 符合以下条件可判断[6, 20, 58, 60-61]: (1)日常活动可引起诸如乏力、气短等非特异性的轻微症状; (2)心肌损伤标志物(cTn、CK、CK-MB、天冬氨酸转氨酶)和利钠肽轻度升高[62]; (3)心电图轻度异常,包括新发窦速、房性心律失常、非特异性ST-T改变; (4)不伴有超声心动图或心脏MRI心肌结构和功能异常。 |
| 重症型 | 符合以下条件可判断[6, 20, 22, 58, 60-61]: (1)日常活动即可引起乏力、心悸、胸痛、肌肉酸痛等明显症状,但不伴有血流动力学改变; (2)心肌损伤标志物(cTn、CK、CK-MB、天冬氨酸氨基转移酶)和利钠肽明显升高; (3)心电图新出现Ⅰ~Ⅱ度房室传导阻滞,束支传导阻滞、室内传导阻滞、频发室性早搏,QT延长、或出现广泛ST段抬高及T波改变、R波振幅降低甚至异常Q波,但排除急性心肌梗死; (4)伴有超声心动图或心脏MRI心肌结构和功能异常。 |
| 危重型 | 符合以下条件可判断[6, 20, 22, 58, 60-61]: (1)低于日常活动量甚至静息状态即出现无法耐受的症状,如呼吸功能障碍、心力衰竭、心源性休克等,血流动力学不稳定,危及生命; (2)心肌损伤标志物(cTn、CK、CK-MB、天冬氨酸氨基转移酶)和利钠肽显著升高; (3)超声心动图或心脏MRI可见明显心脏结构异常,伴随明显的收缩和舒张功能受限; (4)心电图新出现严重心律失常,包括室性心动过速,心室颤动,或高度和Ⅲ度房室传导阻滞需安装临时起搏器。 |
主要证据
一项关于ICIs相关心肌炎诊断的系统性综述[19]汇总了2011—2018年发表的46例病例报告、4个病例系列和一项观察性研究数据,结果显示大多数ICIs相关心肌炎患者的心肌损伤标志物升高:在收集了心肌损伤标志物数据的患者中,约98%的患者cTnT和/或cTnI升高,约87%的患者利钠肽升高,100%患者的CK升高;且cTnT、cTnI和CK水平与病情严重程度正相关。
临床一般根据患者日常活动是否会引起临床症状以及心肌损伤标志物和/或心电图是否异常将ICIs相关心肌炎由轻至重依次分为亚临床心肌损伤、轻症型ICIs相关心肌炎、重症型ICIs相关心肌炎和危重型ICIs相关心肌炎4个等级。如表 1所示,亚临床心肌损伤,表现为患者日常活动不会引起临床症状,仅表现为cTn轻度升高,但无其他心肌损伤标志物升高,且其他辅助检查均无异常。轻症型ICIs相关心肌炎,患者日常活动可引起诸如乏力、气短等非特异性的轻微症状;或有心肌损伤标志物(cTn、CK、CK-MB、天冬氨酸转氨酶)和利钠肽轻度升高;或心电图轻度异常,包括新发窦速、房性心律失常、非特异性ST-T改变;但不伴有超声心动图或心脏MRI心肌结构和功能异常。重症型ICIs相关心肌炎,患者日常活动即可引起乏力、心悸、胸痛、肌肉酸痛等明显症状,但不伴有血流动力学改变;或心肌损伤标志物(cTn、CK、CK-MB、天冬氨酸氨基转移酶)和利钠肽明显升高;或心电图新出现Ⅰ~Ⅱ度房室传导阻滞、束支传导阻滞、室内传导阻滞、频发室性早搏,QT延长,或出现广泛ST段抬高及T波改变、R波振幅降低甚至异常Q波,但排除急性心肌梗死;或伴有超声心动图或心脏MRI心肌结构和功能异常。危重型ICIs相关心肌炎,患者低于日常活动量甚至静息状态即会出现无法耐受的症状,如呼吸功能障碍、心力衰竭和心源性休克等,患者血流动力学不稳定,危及生命;或心肌损伤标志物(cTn、CK、CK-MB、天冬氨酸氨基转移酶)和利钠肽显著升高;或超声心动图或心脏MRI可见明显心脏结构异常,伴随明显的收缩和舒张功能受限;或心电图新出现严重心律失常,包括室性心动过速、心室颤动或高度和Ⅲ度房室传导阻滞,需安装临时起搏器[6, 20-22, 60-61]。
此外,一项纳入了24例ICIs相关心肌炎患者的回顾性研究[62],基于激素减量期间cTnT变化的情况将ICIs相关心肌炎患者分为激素敏感型和激素抵抗型,其中,激素敏感型患者糖皮质激素规范减量期间,cTnT稳定或下降[62];激素抵抗型患者糖皮质激素规范减量期间,cTnT持续升高[62]。此外,2022年欧洲心脏病学会(European Society of Cardiology,ESC)年会颁布的《2022 ESC肿瘤心脏病学指南》[63]也对激素抵抗型ICIs相关心肌炎(steroid-resistant ICIs-associated myocarditis)进行了定义,即接受至少3 d糖皮质激素和其他心脏相关治疗后,发生下列任一情况:(1)cTn无显著降低(降低幅度小于峰值的50%);(2)房室传导阻滞、室性心律失常或左心室功能不全仍持续存在。对于激素抵抗型心肌炎的治疗,应考虑强化免疫抑制方案或二线免疫抑制方案。
问题8:ICIs相关心肌炎的治疗原则、首选治疗及注意事项是什么?
推荐意见8 若患者发生ICIs相关心肌炎,首先暂缓ICIs治疗,建议请心血管科医师会诊,必要时组建多学科团队会诊,同时完善各项辅助检查。对于确诊为ICIs相关心肌炎的患者,建议首选糖皮质激素治疗,并根据ICIs相关心肌炎的临床分型制定糖皮质激素初始治疗剂量及后续剂量调整方案。糖皮质激素治疗期间应严密监测心肌损伤标志物、心功能指标及并发症,以及时调整治疗策略(图 2)。

|
| 图 2 ICIs相关心肌炎的分型治疗流程图 MDT:多学科会诊;ICU:重症监护室。泼尼松,又名强的松;甲泼尼龙,又名甲基强的松龙、甲基泼尼松龙、甲强龙或甲基氢化泼尼松。泼尼松5 mg等效于甲泼尼龙4 mg。 |
主要证据
ICIs相关心肌炎一旦发生,均应暂缓ICIs治疗,完善心肌损伤标志物(主要包括cTn、Mb、CK-MB和CK)、利钠肽、天冬氨酸氨基转移酶、D-二聚体、白细胞计数、炎性标志物(红细胞沉降率、C反应蛋白)、心电图和超声心动图等检查,条件允许时可行心脏MRI检查[6, 20, 61]。全面评估ICIs相关心肌炎的临床分型,根据不同分型进行相应治疗(图 2)。
系统性综述[37]的结果显示,糖皮质激素治疗是ICIs相关心脏毒性的最佳治疗选择。一项多中心登记研究[5]纳入了8个中心35例ICIs相关心肌炎患者数据进行分析,结果显示89%的患者接受了糖皮质激素治疗,且高剂量的激素治疗可能与较好的预后相关。另一项多中心研究[64]纳入了23个中心126例接受糖皮质激素治疗的ICIs相关心肌炎患者进行研究,结果显示,较高的初始剂量和较早使用糖皮质激素与ICIs相关心肌炎的心脏结局改善相关。
亚临床心肌损伤患者,应加强监测临床表现的进展情况,48~72 h后首次随访cTn。若cTn下降或升高不超过50%(稳定型亚临床损伤),则持续观察随访,直至其恢复至基线水平;若cTn升高超过50%(不稳定型亚临床损伤),则应给予泼尼松0.5~1 mg•kg-1•d-1或其他等效药物治疗,持续治疗3~5 d后开始减量[6, 20]。首次减量25%~40%,后续每周减量5 mg,减量过程不少于4~6周,期间每周复查cTn[20]。
轻症型ICIs相关心肌炎患者,建议请心血管科医师会诊,同时给予甲泼尼龙1~2 mg•kg-1•d-1或其他等效药物治疗,治疗48~72 h后首次随访cTn。对糖皮质激素治疗反应较好的激素敏感型患者,治疗3~5 d后,予以糖皮质激素缓慢撤退和减量,每3~5 d减量25%~40%,减至40 mg/d及以下时调整为口服等效泼尼松,继而每周减量5 mg直至停药。
重症型ICIs相关心肌炎患者建议永久停用ICIs,立即卧床休息,请心血管科医师会诊;推荐给予500 mg甲泼尼龙(或其他等效药物)和0.4 g•kg-1•d-1丙种球蛋白(有条件时)进行治疗。治疗48~72 h后首次随访cTn,如cTn较基线下降,症状好转,可逐渐减量。对糖皮质激素治疗反应较好的激素敏感型患者,治疗3~5 d后,予以激素缓慢撤退和减量,每3~5天激素用量减半,减量至2 mg•kg-1•d-1后则每3~5 d减量25%~40%,减至40 mg/d及以下时调整为口服等效泼尼松龙,继而每周减量5 mg直至停药,每次减量前均需监测cTn。
对于轻症型和重症型患者,若初始糖皮质激素治疗后cTn无下降和(或)症状无缓解,或者在糖皮质激素规范减量过程中cTn持续上升或症状加重,评估为激素抵抗型心肌炎时,建议尽快加用强化免疫抑制治疗,后续考虑降低糖皮质激素减药幅度和延长减药时间间隔。若患者接受强化免疫抑制治疗后,症状仍无缓解,cTn持续上升,则提示预后不佳[6, 20]。对于重症型患者,若存在大剂量糖皮质激素冲击治疗禁忌(如消化性溃疡、上消化道出血、重症感染或糖尿病血糖控制不佳等),可尝试甲泼尼龙1~2 mg•kg-1•d-1和0.4 g•kg-1•d-1丙种球蛋白(有条件时)及直接进行强化免疫抑制治疗。
危重型ICIs相关心肌炎患者建议永久停用ICIs,卧床休息,多学科团队会诊(心血管科、危重症医学科等),给予ICU级别监护;建议立即给予甲泼尼龙500~1 000 mg/d冲击治疗联合丙种球蛋白0.4 g•kg-1•d-1治疗,以及直接联合强化免疫抑制治疗;高度和Ⅲ度房室传导阻滞建议安装临时起搏器;危重症患者应及时给予联合血浆置换和/或生命支持治疗(循环支持、呼吸支持和肾脏替代);治疗期间需每天监测cTn。对激素治疗反应较好的激素敏感型患者,治疗3~5 d后,予以糖皮质激素缓慢撤退和减量,每3~5 d糖皮质激素用量减半,减量至2 mg•kg-1•d-1后则每3~5 d减25%~40%,减至40 mg/d及以下时调整为口服等效泼尼松龙,继而每周减量5 mg直至停药,每次减量前均需监测cTn。若在上述联合治疗后症状不缓解、cTn无变化或升高,或是在糖皮质激素减量过程中症状加重、cTn持续升高,均提示预后不佳[6, 20]。
糖皮质激素治疗期间除监测心肌损伤标志物和心功能指标外,还需严密监测预防高血糖、高血压、低钙血症、深静脉栓塞、骨质疏松以及由细菌、真菌、病毒和肺孢子虫导致的继发感染等并发症[6, 20]。在接受治疗的肿瘤患者中,sST2与多种心肌损伤标志物相关,可能具有预后预测价值,可考虑在治疗中进行监测[43]。
一项纳入126例ICIs相关心肌炎患者的多中心回顾性登记研究[64]显示,与24~72 h和72 h以后启用糖皮质激素治疗相比,24 h内启用糖皮质激素治疗能够更好的降低cTn峰值(32.4% vs 66.7% vs 41.4%,P=0.026),相比中剂量(60~500 mg/d)、低剂量(<60 mg/d)糖皮质激素,接受高剂量(501~1 000 mg/d)糖皮质激素治疗的ICIs患者的心血管事件发生率更低(高、中、低剂量发生率分别为22.0%、54.6%、61.9%,P<0.001)。因此,建议ICIs相关心肌炎患者应尽早启用糖皮质激素治疗,并酌情考虑使用高剂量治疗。高剂量糖皮质激素治疗24~48 h内患者病情无改善时,建议调整免疫抑制治疗方案。
问题9:ICIs相关心肌炎的其他治疗方式及其适应人群有哪些?
推荐意见9 除糖皮质激素外,ICIs相关心肌炎的治疗选择还包括(1)化学药物(吗替麦考酚酯和他克莫司)、小分子靶向药物(托法替布)、生物制剂(英夫利昔单抗、托珠单抗、阿仑单抗、抗胸腺细胞球蛋白和阿巴西普)和免疫球蛋白等药物治疗方案;(2)生命支持治疗,有条件时可行血浆置换和淋巴细胞清除等非药物治疗方案。
主要证据
对于糖皮质激素治疗失败后有如下表现的患者可进行强化免疫抑制治疗:(1)心力衰竭综合征出现、持续和恶化,或LVEF降低的患者;(2)室性心律失常或严重心电传导异常出现、持续或加重的患者;(3)糖皮质激素治疗3 d以上,cTn没有降低或cTn升高的患者;(4)存在严重的非心脏相关的irAEs或者由于没有其他适合治疗方案导致临床医生启用强化免疫抑制治疗的患者[65]。但尚无证据表明糖皮质激素治疗失败后哪种方案最佳[60],因此需根据临床实际情况和用药经验来选择合适的治疗方案[6, 60]。
化学药物治疗:(1)建议吗替麦考酚酯与糖皮质激素联合应用,0.5~1.0 g/次,每12 h 1次[6, 22, 58]。一项报告了6例ICIs相关心肌炎的研究[66]中,2例患者治疗方案中加用了吗替麦考酚酯,其中1例患者的治疗方案为甲泼尼龙(1 000 mg/d)静脉注射3 d,然后减量至1 mg/kg给药7 d,继而改用口服泼尼松治疗,3周后加用吗替麦考酚酯1 500 mg 2次/d口服,治疗6周后患者的CK和高敏cTnT(hs-TnT)恢复正常;另1例患者在甲泼尼龙(2 mg/kg)静脉注射4 d,由于心肌酶未下降,调整为1 000 mg/d静脉注射,3 d后加用吗替麦考酚酯1 000 mg 2次/d口服,治疗1个月后,患者LVEF从35%提高到50%。另一项病例报告[67]报道了1例发生ICIs相关心肌炎的子宫内膜癌患者,在大剂量甲泼尼龙(1 000 mg/d)治疗3 d后,调整为1.5 mg/kg泼尼松联合吗替麦考酚酯1 000 mg 2次/d口服,2个月后患者射血分数由35%提高至59%。(2)亦建议他克莫司与糖皮质激素联合应用,需在有经验的医生指导下应用,且需要监测血药浓度[6, 22, 58]。由于其他药物的使用受限于患者的共病情况,吗替麦考酚酯和他克莫司通常可用于治疗复杂性ICIs相关心肌炎[68]。
小分子靶向药物托法替布5 mg/次,2次/d,可考虑用于激素抵抗型ICIs相关心肌炎的治疗[62]。对前期接受过糖皮质激素治疗且疗效不佳的ICIs相关心肌炎患者的回顾性研究[62]表明,托法替布能够提升激素抵抗型患者的临床获益,56.3%的激素抵抗型ICIs相关心肌炎患者(9/16)联合使用托法替布后,心肌炎症状好转,cTn水平恢复至正常。
生物制剂治疗包括(1)英夫利昔单抗:首次剂量5 mg/kg静脉推注,可在2~6周后第2次用药[6]。合并免疫性肝炎的患者禁用英夫利昔单抗治疗[6]。由于英夫利昔单抗可能会诱发心力衰竭[69],并可能增加患者心血管死亡风险[65],因此合并中重度心力衰竭,即心功能Ⅲ~Ⅳ级且LVEF≤35%的患者用量不宜超过5 mg/kg[6]。(2)托珠单抗:有病例报告报道了1例接受纳武利尤单抗联合伊匹木单抗治疗后发生ICIs相关心肌炎的非小细胞神经内分泌癌患者,在糖皮质激素治疗失败后,加用托珠单抗联合治疗,每周8 mg/kg静脉注射,共注射2次,在激素减量后未出现心脏或心肌炎相关不良事件复发[70]。(3)阿仑单抗:1例接受帕博利珠单抗治疗后发生ICIs相关心肌炎的黑素瘤患者的病例报告[71]显示,激素、吗替麦考酚酯和利妥昔单抗治疗重症ICIs相关心肌炎失败后,加用阿仑单抗30 mg,能使患者心室功能恢复正常,在利妥昔单抗、糖皮质激素和吗替麦考酚酯减量过程中未出现任何心脏不良事件,且ICIs相关心肌炎发生后4个月的影像学随访显示肿瘤完全缓解。(4)抗胸腺细胞球蛋白:有病例报告[72]报道了1例纳武利尤单抗治疗后发生暴发性ICIs相关心肌炎的胶质母细胞瘤患者,在激素和英夫利昔单抗治疗失败后,采用马抗胸腺细胞球蛋白(第1天500 mg,第2~4天以250 mg的增量滴定进行剂量调整,以维持CD2/3在50~100 μL水平)联合口服泼尼松100 mg/d治疗,获得了病理和临床改善,进而接受放射治疗且6个月后MRI显示肿瘤无进展。然而,抗胸腺细胞球蛋白的剂量和疗程尚未明确,治疗时应遵循个体化原则,尽量监测T淋巴细胞亚群计数,同时加强不良反应监测并预防机会性感染[6]。(5)阿巴西普:虽有病例报告[73]显示,阿巴西普每2周500 mg静脉注射,共注射5次的方案成功治疗了1例激素联合血浆置换治疗失败的ICIs相关心肌炎患者,使其cTn水平迅速下降、心室过度应激情况3周内消退、LVEF恢复正常、心肌炎症状逐渐减轻,且在阿巴西普治疗1个月后的影像学检测显示肿瘤未进展,但因阿巴西普可能有促肿瘤生长风险,建议仅在其他治疗方案无效的重症型和危重型ICIs相关心肌炎患者中考虑应用[6]。
静脉注射免疫球蛋白总量2 g/kg,前2 d 20~40 g/d,第3天开始10~20 g/d,连用5~7 d后停用[6, 40]。虽尚缺乏前瞻性临床试验的证据,但有小样本研究[74]回顾性分析了6例急性暴发性心肌炎患者的临床资料,结果显示患者在接受免疫球蛋白治疗后,耐受良好,LVEF从基线时的(21.7±7.5)%提高到出院时的(50.3±8.6)%(P=0.005),且在中位时间为13.2个月的随访中,无患者因充血性心力衰竭再入院,提示了静脉注射免疫球蛋白对ICIs相关心肌炎有效。
血浆置换和淋巴细胞清除主要用于治疗ICIs所致神经系统不良反应,但临床实践中也可考虑用于ICIs相关心肌炎的治疗,建议有条件时可以行血浆置换和淋巴细胞清除。
生命支持治疗包括循环支持、呼吸支持和肾脏替代等3个方面[6, 40],主要包括主动脉内球囊反搏、体外膜肺氧合、呼吸机辅助呼吸和临时起搏器植入等措施[40, 75]。
建议根据药物可及性和临床医师的用药经验选择联合治疗方案。若选择糖皮质激素联合化学药物方案,不推荐同时使用吗替麦考酚酯和他克莫司;若选择糖皮质激素联合2种生物制剂,则可考虑糖皮质激素联合抗胸腺细胞球蛋白(或阿巴西普)和英夫利昔单抗的治疗方案[6]。
联合治疗方案的选择还需综合考虑ICIs相关心肌炎的临床分型及对糖皮质激素治疗的反应。轻症型ICIs和重症型ICIs相关心肌炎患者若糖皮质激素初始治疗后症状不缓解、cTn无下降,或糖皮质激素减量过程中症状加重、cTn持续上升,均推荐加用强化免疫抑制治疗。危重型ICIs相关心肌炎患者建议直接采用强化免疫抑制治疗方案。若条件许可,危重型ICIs相关心肌炎患者可考虑联合血浆置换和生命支持治疗等措施(图 2)[6]。
对ICIs相关心肌炎的治疗仍在不断探索中,在小鼠模型中已经证明西红花总苷一定程度上可以改善ICIs相关心肌炎[76],这一结果可能为ICIs相关心肌炎提供一种新的治疗选择。与此同时,多学科联合诊疗模式为ICIs相关心肌炎的治疗带来更多选择和更完备的治疗方案。
问题10:ICIs相关心肌炎治疗过程中其他注意事项有哪些?
推荐意见10 ICIs相关心肌炎治疗过程中建议监测肿瘤及其他原有疾病的进展,预防并发症的发生。
主要证据
ICIs相关心肌炎治疗过程中,建议关注包括肿瘤和心血管疾病在内的原有疾病的进展,预防治疗相关并发症,如高血糖、高血压、电解质紊乱、水钠潴留、低钙血症、深静脉栓塞、骨质疏松、肥胖及继发细菌、真菌、病毒、肺孢子肺炎和疱疹复发机会感染等[6, 20]。连续使用4周及以上治疗方案为泼尼松20 mg或等效剂量,1次/d的患者,建议采取预防卡氏肺孢子肺炎的治疗;连续使用6~8周及以上治疗方案为泼尼松20 mg或等效剂量,1次/d的患者,建议实施预防真菌感染的措施[22]。在ICIs相关心肌炎的糖皮质激素治疗过程中,除急性胃黏膜病变、消化性溃疡等治疗适应证可予质子泵抑制剂治疗外,其余情况需谨慎使用质子泵抑制剂,因其可能缩短患者的生存期[77]。如需预防消化性溃疡,建议使用H2受体拮抗剂和胃黏膜保护剂[6]。另外,长期使用糖皮质激素治疗的患者还需谨防发生骨质疏松,应补充维生素D和钙剂[22]。
5 ICIs相关心肌炎监测、转归与治疗重启问题11:ICIs相关心肌炎应如何监测与随访?
推荐意见11 ICIs相关心肌炎的病情发展迅速且死亡率较高,在心肌炎症状缓解期间也应进行定期监测和随访。推荐在糖皮质激素减量期间每周监测1次患者的症状体征、心电图和心肌损伤标志物;在糖皮质激素停用的3个月内,至少每2~3周监测1次患者症状体征、心电图和心肌损伤标志物。
主要证据
一项病例报告[78]报道了1例黑素瘤患者,经纳武利尤单抗联合伊匹木单抗治疗后发生ICIs相关心肌炎,患者在应用1 mg•kg-1•d-1甲泼尼龙1周后,症状得到临床改善,在第2周和第8周复查时,患者的LVEF已从15%提高至25%和30%,临床症状完全消退;在糖皮质激素减量期间,每周或每2周进行1次超声心动图,密切监测患者心脏功能。另1例接受纳武利尤单抗联合伊匹木单抗的患者也在ICIs治疗后发生了ICIs相关心肌炎,在大剂量静脉注射糖皮质激素3 d后,cTnI水平显著下降,但在停用糖皮质激素治疗后cTnI水平迅速飙升,后在长达5个月的泼尼松10 mg/d治疗后,cTnI水平逐渐恢复正常[79]。因此,在心肌炎症状缓解期间也应进行定期监测和随访。
ICIs相关心肌炎的主要临床结局为心血管死亡、心脏骤停、心源性休克和完全性心脏传导阻滞[77],死亡率为39.7%~66%[4, 8]。一项观察性研究[80]分析了48例发生ICIs相关心肌炎的患者,并根据临床表现将患者分为暴发性心肌炎、临床型心肌炎和亚临床型心肌炎3组进行分析,暴发性心肌炎特征为血流动力学不稳定或心电不稳定,相比于临床型和亚临床型心肌炎,暴发性心肌炎组患者的心血管死亡率最高(87.5% vs 4.0% vs 0.0%,P<0.01),且所有发生ICIs相关心肌炎患者的心血管死亡率为16.7%。
此外,ICIs治疗后发生irAEs的患者总体预后优于未发生irAEs的患者[81-82]。一项多中心、回顾性队列研究[81]分析了623例接受ICIs治疗的非小细胞肺癌患者发现,与ICIs治疗过程中未发生irAEs的患者相比,发生irAEs患者(包含心肌炎)的OS[校正后单系统及多系统irAE的HR分别为:0.86(95%CI 0.66~1.12,P=0.26)、0.57(95%CI 0.38~0.85,P=0.005)]和PFS[校正后单系统及多系统irAE的HR分别为0.68(95%CI 0.55~0.85,P=0.001)、0.39(95%CI 0.28~0.55,P<0.001)]均改善。
问题12:ICIs治疗重启的条件及其注意事项是什么?
推荐意见12-1 任何分型ICIs相关心肌炎,在未彻底治愈之前不推荐重启ICIs治疗。亚临床心肌损伤患者在心肌损伤标志物恢复基线水平后可考虑重启ICIs治疗,轻症型ICIs相关心肌炎患者在心肌损伤标志物恢复基线水平后慎重再次进行ICIs治疗,重症型ICIs相关心肌炎和危重型ICIs相关心肌炎患者需永久停用ICIs治疗。
推荐意见12-2 无其他可替代治疗的患者,需由心血管科和肿瘤科医师共同讨论后决定是否重启ICIs治疗。接受1种ICIs治疗的亚临床心肌损伤患者,在继续ICIs治疗后再次出现持续进展的亚临床心肌损伤,可考虑在再次治愈后更换其他ICIs;原方案为PD-1或PD-L1抑制剂联合CTLA-4抑制剂治疗的患者,可以考虑更改为PD-1或PD-L1抑制剂单药治疗。所有重启ICIs治疗的患者需密切监测其症状变化,并增加心肌损伤标志物的监测频率。
主要证据
发生ICIs相关心肌炎的患者,在心肌炎治愈后重启ICIs治疗,心肌炎复发的可能性取决于首次心肌炎的严重程度[35]。一项队列研究[35]分析了ICIs治疗重启后不同irAEs的复发率对ICIs终止治疗的影响发现,初始irAEs为ICIs相关心肌炎的3例患者在重启ICIs治疗后,无患者在随访时间内出现心肌炎复发。Allouchery等[83]发现,2例患者在既往ICIs治疗时因发生3/4级ICIs相关心肌炎而暂停治疗,在重启治疗后,1例患者出现心肌炎复发。另一项病例报告[84]也报道了1例发生ICIs相关心肌炎的患者在心肌炎治愈后成功重启ICIs治疗,且该患者在治疗期间和随访11个月内没有发生心血管并发症。一项回顾性研究[85]分析了在ICIs治疗期间发生了ICIs相关心肌炎的7例患者,其中有3例患者在同时使用低剂量糖皮质激素和每周监测cTn的情况下重启ICIs治疗,ICIs相关心肌炎分级为Ⅰ级和Ⅱ级(分级标准参考2018 ASCO指南[86])的2例患者重启治疗成功,在重启治疗期间肿瘤缓解且无心血管症状复发,分级为Ⅲ级的1例患者在第1轮重启治疗后心血管症状恶化,永久停用了ICIs治疗。
若患者无其他可替代的抗肿瘤治疗方案,是否重启ICIs治疗需要结合患者情况进行多学科会诊,包括癌症状况、既往治疗效果、心脏毒性严重程度、免疫治疗后毒性消退和患者偏好等[6, 87]。
6 典型病例诊治经验以下为复旦大学附属中山医院肿瘤心脏病多学科团队诊治的4例ICIs相关心肌炎典型病例,以供参考。
病例1(亚临床型ICIs相关心肌炎)
患者,男性,46岁。主诉:确诊肝恶性肿瘤5个月余,肌钙蛋白升高1 d。
现病史:患者2020年12月因“肝占位”就诊,上腹部增强MRI(2020年12月26日)结果显示,肝脏巨块结节恶性肿瘤,肝硬化伴多发硬化或坏死结节,门脉高压伴脾肾分流、脾大、少量腹水。结合患者慢性乙型肝炎病史,临床诊断为肝细胞癌,于2021年1月5日开始第1周期治疗,仑伐替尼12 mg d1~d21+信迪利单抗200 mg d1,每3周1次。患者2021年4月7日拟行第4周期治疗入院,入院常规检查发现心肌损伤标志物升高,2021年4月8日检测cTnT 0.060 ng/mL(正常值0~0.030 ng/mL)。为求进一步诊治,收入病房。
既往病史:有慢性乙型肝炎病史,2型糖尿病病史5年。否认冠心病、高血压等其他慢性病史。否认结核等其他传染病史。否认手术、外伤史。否认药物、食物过敏史。
专科查体:体温36.8 ℃,心率76次/min,呼吸18次/min,血压140/92 mmHg(1 mmHg=0.133 kPa)。神清,全身皮肤无黄染,无肝掌、蜘蛛痣。全身浅表淋巴结无肿大,巩膜无黄染,一般情况可。双肺呼吸音低,未及干湿啰音。心率76次/min,律齐,未及明显杂音。腹软,肝脾肋下未及,肝肾区无叩击痛,无压痛反跳痛,双下肢未及明显水肿。
辅助检查:2021年4月7日心电图检查结果正常。
临床诊疗经过:患者后续进一步完善相关检查,暂停抗肿瘤治疗。2021年4月8日查CK、CK-MB、Mb、利钠肽、D-二聚体、天冬氨酸氨基转移酶、血常规、甲状腺功能、ACTH及皮质醇水平均正常。2021年4月8日超声心动图结果显示,静息状态下超声心动图未见明显异常,LVEF为67%。2020年4月9日心脏平扫+增强MRI结果显示,左室心肌散在水肿伴少许延迟强化,心肌炎可能性较大,建议治疗后复查。患者目前无明显症状,仅cTnT升高,评估为亚临床型,暂未予激素治疗,密切随访。2020年4月10日查cTnT 0.059 ng/mL。2020年4月15日查cTnT 0.066 ng/mL。患者随访cTnT指标稳定,评估为亚临床稳定型,每周复查心肌损伤标志物。2020年5月28日查cTnT 0.029 ng/mL,恢复正常,恢复后续抗肿瘤治疗。
病例总结:该患者结合实验室检查和心脏MRI明确为ICIs相关心肌炎,但患者起病无临床症状,仅cTnT升高,并且在病程中随访cTnT保持稳定。评估此患者为亚临床稳定型心肌损伤,予以暂停抗肿瘤治疗并进行密切随访,未进行糖皮质激素治疗。该患者后续心肌损伤标志物水平自行下降,恢复正常。对于亚临床稳定型心肌损伤患者,确实可密切观察随访,避免不必要的糖皮质激素治疗。根据回顾性研究[5],与对照组相比,心肌炎病例组患有糖尿病(34% vs 13%,P=0.01)的患者比例更高。2型糖尿病病史可能为该患者发生ICIs相关心肌炎的高危因素。
病例2(轻症型ICIs相关心肌炎)
患者,女性,62岁。主诉:确诊胆管腺癌3个月,肌钙蛋白升高1 d。
现病史:患者2021年1月因“胆结石”就诊,2021年1月5日上腹部增强MRI示肝门部及肝右叶占位,伴梗阻性肝内胆管扩张,考虑胆管恶性肿瘤可能性较大。肝右叶肝内胆管多发结石可能;肝门部及腹膜后多发肿大淋巴结。2021年1月5日外院经内镜逆行胰胆管造影(encoscopic retrograde cholangio-pancreatography,ERCP)示肝门部胆管恶性肿瘤可能,术中放置塑料支架。胆道刷检病理提示高度异型腺上皮细胞,腺癌不除外。患者进一步完善PET/CT(2021年1月20日),结果显示肝脏右叶至肝门处胆管源性恶性肿瘤伴肝内胆管扩张,多发(腹腔、腹膜后、锁骨区)淋巴结转移;腹盆腔多发种植转移以及脐部转移。患者于2021年1月28日、2021年2月18日予以姑息一线抗肿瘤治疗,给予特瑞普利单抗240 mg d1+仑伐替尼8 mg d1~d21+吉西他滨1.4 g d1,d8+奥沙利铂120 mg d1,每3周1次。2021年3月1日起拟行第3周期治疗时,常规检查发现心肌损伤标志物异常(cTnT 0.050 ng/mL),同时出现关节疼痛。患者为进一步诊治入院。
既往病史:既往类风湿关节炎病史,疾病稳定未用药。此次特瑞普利单抗第2次治疗后关节疼痛再发,外用药物控制。否认高血压病、糖尿病病史,否认药物过敏史。2001年有胆囊结石手术病史。
专科查体:一般情况可,血压145/95 mmHg。神清,无贫血貌,双肺呼吸音清,未及干湿啰音。心脏扩大,心率80次/min,律齐,未及明显杂音。腹软,无压痛反跳痛,肝脾肋下未及。双下肢未及明显水肿。
辅助检查:2021年3月2日,CK、CK-MB、Mb、利钠肽、D-二聚体、天冬氨酸氨基转移酶、血常规、甲状腺功能、ACTH及皮质醇水平均正常。2021年3月2日心电图检查结果正常。2021年3月3日静息状态下超声心动图未见异常。2021年3月3日心脏MRI结果:左室心肌少许水肿伴延迟强化,存在心肌炎可能。
临床诊疗经过:患者完善检查,目前cTnT升高,同时合并关节肿痛,考虑为类风湿关节炎活动可能,评估为轻症型ICIs相关心肌炎。暂缓所有抗肿瘤治疗,同时2021年3月4日开始甲泼尼龙60 mg静脉治疗5 d,cTnT稳定于0.054~0.059 ng/mL。患者2021年3月9日开始调整为甲泼尼龙40 mg qd口服,同时每周监测cTnT。患者心肌损伤标志物稳定下降,甲泼尼龙每周减量4 mg直至完全停药。后续心肌损伤标志物恢复正常,同时开始仑伐替尼联合GEMOX方案化疗[吉西他滨1 000 mg/m2,静脉滴注30 min,d1、d8;奥沙利铂130 mg/m2,静脉滴注2 h,d1]。
病例总结:该患者为晚期胆管癌合并多处转移,姑息一线治疗方案选择免疫联合靶向和化疗。患者免疫治疗2个周期后发现cTnT升高,心脏MRI可见左室心肌少许水肿伴延迟强化,无心肌结构和功能异常,其余辅助检查未见异常。患者既往有类风湿性关节炎病史,同时联合应用抗血管生成药物,这可能是导致患者出现ICIs相关心肌炎的高危因素。结合患者临床表现、实验室检查和心脏MRI检查,诊断为轻症型ICIs相关心肌炎,予以1 mg/kg甲泼尼龙起始治疗,后续监测cTnT缓慢下降,予以缓慢撤退减量。后续患者心肌损伤标志物恢复后,予以恢复靶向联合化疗,未再予以免疫治疗。
病例3(重症型ICIs相关心肌炎,激素敏感型)
患者,男性,61岁。主诉:确诊肝恶性肿瘤1年半,乏力3 d伴黑矇1次。
现病史:患者于2020年7月22日因肝右叶恶性肿瘤行“特殊肝段切除术+肠粘连松解术”,术后病理诊断为肝细胞癌。患者术后定期随访,2021年10月复查上腹部增强MRI示肝内多处复发。患者于2021年11月4日参加特瑞普利单抗联合索拉非尼治疗无法手术切除的中晚期肝细胞癌开放、单臂、多中心探索性研究,于2021年11月4日开始予以特瑞普利单抗240 mg d1联合口服索拉非尼0.4 g每日2次,每3周1次。末次特瑞普利单抗治疗时间为2022年1月6日。患者于2022年1月25日开始自觉周身乏力,晨起黑矇1次,无意识丧失,躺下休息后好转。患者于2022年1月27日门诊心电图提示Ⅰ、aVL、V2~V6导联ST段抬高0.5~5 mm,cTnT 1.84 ng/mL。为进一步诊治收住入院。
既往病史:高血压病史10余年,服用硝苯地平缓释片20 mg qd,血压控制于130/80 mmHg左右。否认心脏病、糖尿病和高脂血症史。否认结核等其他传染病史。手术史见现病史。否认外伤史。否认药物、食物过敏史。
专科查体:体温36.5℃,心率78次/min,呼吸20次/min,血压117/76 mmHg。神志清晰,精神疲软。全身皮肤和巩膜无黄染,无肝掌、蜘蛛痣。全身浅表淋巴结未及肿大。双肺呼吸音清,未及干湿啰音。心率78次/min,律齐,未及明显杂音。腹软,肝脾肋下未及,肝肾区无叩击痛,无压痛反跳痛,双下肢无明显水肿。
辅助检查结果为2022年1月28日查cTnT:2.87 ng/mL,氨基末端利钠肽原(N-terminal pro-B-type natriuretic peptide,NT-proBNP):7 590 pg/mL,CK-MB:50 U/L,CK-MM:447 U/L,rT3:1.9 mmol/L,rT4:7.9 nmol/L,促甲状腺激素(thyroid stimulating hormone,TSH):8.12(0.27~4.2 μIU/mL),D-二聚体:0.35 mg/L,天冬氨酸转氨酶:128 U/L,C反应蛋白(CRP):60.0 mg/L。
2022年1月28日心电图:窦性心律,Ⅰ、aVL、V2~V6导联ST段抬高0.5~5 mm,下壁导联ST段压低。2022年1月28日超声心动图:左室壁增厚,左室纵向收缩活动减弱,极少量心包积液,LVEF为60%。
临床诊疗经过:患者入院后完善冠状动脉CT血管造影检查,排除急性冠脉综合征后,诊断为ICIs相关心肌炎合并甲状腺炎。暂停抗肿瘤药物。予以甲泼尼龙500 mg联合丙种球蛋白20 g静脉治疗,同时给予左甲状腺素75 μg每日口服。患者3 d后胸闷乏力明显好转,心肌标志物改善明显,甲泼尼龙减量至240 mg,停用丙种球蛋白,左甲状腺素加量至100 μg每日口服。
2022年1月28日冠状动脉CT血管造影:左前降支中段浅表心肌桥,右冠起始段少许软斑块。2022年1月29日cTnT:1.42 ng/mL,NT-proBNP:4 525 pg/mL。2020年2月1日cTnT:0.393 ng/mL,NT-proBNP:1 483 pg/mL。2020年2月7日cTnT:0.052 ng/mL,NT-proBNP:423.8 pg/mL。2020年2月12日cTnT:0.021 ng/mL(恢复正常),NT-proBNP:327.0 pg/mL
患者出院时无明显不适,cTnT恢复正常,口服甲泼尼龙16 mg qd,左甲状腺素125 μg qd。
病例总结:患者在ICIs联合抗血管生成药物用药4个周期后,出现乏力、黑矇等肿瘤患者中常见的非特异性症状,心肌损伤标志物cTnT和利钠肽均明显升高,心电图提示多导联ST段抬高,超声心动图提示左室纵向收缩活动减弱。患者血流动力学尚稳定,同时患者合并甲状腺功能减退,可加重其临床症状。
ICIs相关心肌炎应考虑其他可能疾病的鉴别诊断,包括急性冠状动脉综合征、肺栓塞、原发性心血管疾病加重、肿瘤进展及其并发症、其他抗肿瘤治疗相关心血管并发症、肾功能衰竭、重度感染、主动脉夹层以及其他原因导致的心肌炎等。本例患者心电图Ⅰ、aVL、V2~V6导联ST段抬高0.5~5 mm,下壁导联ST段压低;cTnT明显升高,鉴别诊断方面,首要排除心肌梗死急性期。但患者无明显胸痛,结合ICIs用药史、1 d内心电图无明显变化的情况,初步考虑ICIs相关心肌炎可能大。患者进一步完善冠状动脉CT血管造影检查排除急性冠脉综合征,为后续大剂量激素冲击治疗提供依据。肿瘤患者中常见的肺动脉栓塞引起cTnT升高的情况也通过D-二聚体的检查予以鉴别。
该患者日常活动明显乏力,但不伴有血流动力学不稳定,结合心电图、超声心动图和心肌标志物情况,符合重症型ICIs相关心肌炎诊断标准,给予500 mg甲泼尼龙和丙种球蛋白治疗;同时针对甲状腺功能减退,及时给予外源性左甲状腺素补充治疗。患者治疗过程中激素减量顺利,出院前cTnT已恢复正常,门诊随访,继续激素减量。
病例4(危重型ICIs相关心肌炎,激素抵抗型)
患者,女性,68岁。主诉:确诊淋巴瘤3年半,胸闷气促8 d。
现病史:患者于2016年7月无明显诱因发现右锁骨上肿块,有压痛,行PET/CT检查提示全身多处淋巴结肿大伴糖代谢异常增高。右侧颈淋巴结和纵隔淋巴结活检病理提示霍奇金淋巴瘤,混合细胞型。患者接受ABVD方案化疗,给予多柔比星60 mg d1、d15,博来霉素15 mg d1、d15,长春地辛4 mg d1、d15和达卡巴嗪0.65 g d1、d15,每28天1次,共化疗4个周期,后续予以放疗。患者规律随访,2019年10月腹、盆腔增强CT示右膈角、腹主动脉旁淋巴结肿大,肝门部、腹膜后小淋巴结。考虑患者霍奇金淋巴瘤复发,于2019年12月3日予以信迪利单抗200 mg治疗。患者于2019年12月13日出现胸闷气促,外院急诊发现心肌标志物异常升高,cTnT 0.229 ng/mL(正常值0~0.030 ng/mL),对症治疗后症状未好转。患者于2019年12月20日出现胸闷气促加重,同时出现肌肉酸痛乏力,胃纳不佳,复查cTnT升高达0.417 ng/mL,ALT/AST:321/380 U/L,CK:8 444 U/L,CK-MB:254 U/L,CK-MM:8 190 U/L。为进一步诊治收住入院。
既往病史:否认心脏病、糖尿病和高脂血症史。否认结核等其他传染病史。否认外伤史。否认药物、食物过敏史。患者于2015年行左乳癌改良根治术,术后病理提示浸润性导管癌。腋窝淋巴结转移(1/6)。免疫组化示ER(++)、PR(个别+)、HER-2(+)、Ki67(30%+)。患者术后予ECT方案,表柔比星120 mg d1,环磷酰胺800 mg d1和多西他赛120 mg d1,每3周1次,共化疗4个周期。化疗后继续予以来曲唑内分泌治疗。
专科查体:体温36.8℃,心率104次/min,呼吸24次/min,血压177/93 mmHg。神志清晰,精神疲软。全身皮肤和巩膜无黄染,无肝掌、蜘蛛痣。全身浅表淋巴结未及肿大。双肺呼吸音低,未及干湿啰音。心率104次/min,律齐,未及明显杂音。腹软,肝脾肋下未及,肝肾区无叩击痛,无压痛反跳痛,双下肢无明显水肿。
辅助检查结果为,2019年12月24日,cTnT:0.363 ng/mL,NT-proBNP:507 pg/mL,CK:6 914 U/L,CK-MB:199 U/L,CK-MM:6831 U/L,Mb:1 939 ng/mL,ALT/AST:285/274 U/L。血常规、甲状腺功能、D-二聚体、ACTH及皮质醇水平正常。
2019年12月24日心电图:窦性心动过速,完全性右束支传导阻滞,QRS电轴右偏。2019年12月24日胸片:两下肺少许慢性炎症。
临床诊疗经过:患者于2019年12月24日入院,停用所有抗肿瘤治疗,立即给予甲泼尼龙500 mg静脉冲击治疗3 d,同时给予扩血管、利尿、胃黏膜保护等对症治疗。2019年12月27日患者症状无改善,胸闷气促加重,心悸、喘憋明显,血压180/100 mmHg,鼻导管吸氧5 L/min状态下氧饱和度93%。两下肺听诊可闻及细湿啰音,下肢轻度浮肿,每日尿量800~1 000 mL。患者甲泼尼龙冲击后复查cTnT升至0.97 ng/mL,NT-pro BNP:2023 pg/mL。Mb较前恢复至737.0 ng/mL,ALT/AST:249/66 U/L。肿瘤心脏病多学科讨论考虑心肌炎需加强循环支持,建议转入心脏重症监护室(cardiac care unit,CCU)继续治疗。
患者于2019年12月27日转入CCU,仍有心悸胸闷、呼吸急促。给予心电图、血压、氧饱和度监测,双水平气道正压通气呼吸机(bilevel positive airway pressure,BiPAP)吸氧辅助通气,继续利尿、维持电解质平衡、胃黏膜保护剂等对症支持处理。治疗期间发现患者随机血糖波动于9.9~33.0 mmol/L,给予皮下生物合成人胰岛素注射液10U-12U-14U每日3次,三餐前0.5 h,注射甘精胰岛素注射液16 U,睡前注射,每晚1次,并加用二甲双胍0.5 g每日3次,餐后即服,血糖逐渐控制平稳。多学科会诊讨论意见:(1)患者大剂量甲泼尼龙500 mg冲击治疗3 d后cTnT升高,考虑为激素抵抗型心肌炎,需接受强化免疫抑制治疗,立即加用Janus激酶(Janus kinases,JAK)抑制剂托法替布5 mg bid口服治疗;(2)患者出现血糖波动,考虑为糖皮质激素不良反应,甲泼尼龙先减半至240 mg qd;(3)同时进行血浆置换治疗,每次血浆1 500~2 000 mL。患者在入CCU第2天和第5天,2次进行血浆置换术。入监护室处理后,患者尿量增加明显,首日尿量达4 800 mL,继续维持出入水量负平衡,患者入CCU 7 d后胸闷喘憋有所好转,能配合完成心脏MRI检查,同时甲泼尼龙逐渐减量。
2019年12月27日床旁超声心动图:静息状态下超声心动图未见明显异常,LVEF为65%。2020年1月3日心脏平扫+增强MRI:左室心肌可疑略肿胀,左室下侧壁心外膜下少许延迟强化,可符合心肌炎改变。2019年12月27日cTnT:0.97 ng/mL,CK-MM:694 U/L,NT-proBNP:2 023 pg/mL。2020年1月1日cTnT:0.643 ng/mL,CK-MM:248 U/L,NT-proBNP:1 077 pg/mL。2020年1月8日cTnT:0.589 ng/mL,CK-MM:169 U/L,NT-proBNP:864 pg/mL。
患者症状改善明显,转出CCU至肿瘤内科病房继续治疗,出院时继续服用甲泼尼龙和托法替布,门诊随访。
病例总结:该患者在首次使用ICIs后较早起病,2周即出现胸闷气促症状,伴有肌肉酸痛,实验室检查发现cTnT、NT-proBNP、CK、ALT、AST升高,首先考虑ICIs相关心肌炎合并肌炎。
从心血管系统的客观检查和评估上,患者入院时体格检查肺部啰音范围小于1/2、下肢轻度浮肿,心肌标志物的升高属于轻度升高。但患者临床症状严重,呼吸困难加重尤为明显,出现氧饱和度下降,临床上评估为危重型。对于ICIs相关心肌炎,当合并肌炎和其他系统受损时,必然使其病理生理过程复杂化,转归恶化,故在重症型和危重症的ICIs相关心肌炎评估中需要合并斟酌其他系统irAE的协同作用。
而且不同于冠心病急性心肌梗死的心肌损伤相对局限于罪犯血管供血区域,ICIs相关心肌炎虽然心肌损伤标志物升高不及急性心肌梗死显著,但影响的心肌范围更为广泛,危重型往往累及左右心室,同时出现左右心功能不全导致的包括且不限于肺淤血、体循环淤血的情况,同时影响心脏的舒张和收缩功能。床旁心脏超声若仅简单评估心脏收缩功能恐难以及时反映心脏受损,可考虑检测更为敏感的心脏超声指标,如左心室整体纵向应变(left ventricular global longitudinal strain,LVGLS)。
该例患者病程中症状明显,卧床状态下胸闷气促、呼吸困难。入院后予以甲泼尼龙500 mg冲击3 d后,出现糖皮质激素抵抗的现象,具体表现为血压持续升高,出现肺部湿啰音和下肢浮肿,尿量不增加,吸氧状态下氧饱和度仍出现下降,心肌标志物cTnT继续升至最高(0.97 ng/mL),NT-proBNP升高至2 023 pg/mL。患者合并的肌炎也一度加重其病情,表现为呼吸肌乏力和胃纳不佳,病程中还出现糖皮质激素用药后的血糖波动。对于该患者按照危重型处理策略,给予CCU级别生命体征监护,糖皮质激素联合JAK抑制剂托法替布强化免疫抑制治疗,并及时给予血浆置换治疗,有效抑制炎症因子风暴。该患者后续症状改善、尿量增加,心肌标志物也逐渐恢复,治疗取得阶段性效果。
对于危重型ICIs相关心肌炎患者,诊断明确后需立即给予甲泼尼龙500~1 000 mg冲击,有条件时联合0.4 g•kg-1•d-1丙种球蛋白静脉用药。大剂量糖皮质激素联合丙种球蛋白治疗后若症状不缓解,心肌损伤标志物无明显下降,考虑为激素抵抗型时,需尽快加用强化免疫抑制药物。本例激素抵抗型心肌炎患者在加用JAK抑制剂托法替布强化免疫抑制治疗并联合血浆置换后,病情改善。根据复旦大学附属中山医院肿瘤心脏病多学科团队目前经验,对于危重型患者,丙种球蛋白和强化免疫抑制治疗可以更积极更早期加用。
此外,该患者既往乳腺癌和霍奇金淋巴瘤治疗中暴露过大剂量蒽环类药物,起病时总体蒽环类药物剂量累及已达峰值。蒽环类药物使用病史可能为患者本次ICIs相关心肌炎暴发起病的高危因素。此外,该例患者在ICIs首次给药后,约2周时即出现胸闷气促症状,本应高度警惕ICIs相关心肌炎,拖延至用药后3周时才引起重视,早期识别的缺失,直接延误治疗措施的开展,也是其最终发展为危重型的原因,值得吸取教训。
ICIs相关心肌炎为高致死性免疫不良反应,早期识别、准确分型和规范治疗能够及时发现轻症患者,改善重症患者不良预后。然而,由于ICIs相关心肌炎的诊疗路径尚处于探索阶段,对此需要肿瘤相关专科医师与心血管医师在诊疗过程中共同合作,通过建立多学科联合机制,成立专业的肿瘤心脏病学团队,制定规范的诊疗流程,一起努力为ICIs相关心肌炎患者的诊疗提供具有实践性的指导意见和建议。
专家顾问(按姓氏拼音排序):
卜军 上海交通大学医学院附属仁济医院
陈佳艺 上海交通大学医学院附属瑞金医院
卢仁泉 复旦大学附属肿瘤医院
沈玲红 上海交通大学医学院附属胸科医院
沈赞 上海交通大学附属第六人民医院
汪成 上海交通大学医学院附属第九人民医院黄浦分院
王佳蕾 复旦大学附属肿瘤医院
王群山 上海交通大学医学院附属新华医院
曾军 上海交通大学医学院附属第九人民医院黄浦分院
张献玲 同济大学附属上海市第十人民医院
赵健元 上海交通大学医学院附属新华医院
利益冲突:所有作者声明不存在利益冲突。
| [1] |
KHAN Z, HAMMER C, GUARDINO E, et al. Mechanisms of immune-related adverse events associated with immune checkpoint blockade: using germline genetics to develop a personalized approach[J]. Genome Med, 2019, 11(1): 39.
[DOI]
|
| [2] |
WANG Y, ZHOU S, YANG F, et al. Treatment-related adverse events of PD-1 and PD-L1 inhibitors in clinical trials: a systematic review and meta-analysis[J]. JAMA Oncol, 2019, 5(7): 1008-1019.
[DOI]
|
| [3] |
GUO X X, WANG H P, ZHOU J X, et al. Clinical diagnosis and treatment recommendations for cardiac adverse reactions related to immune checkpoint inhibitor[J]. Chin J Lung Cancer, 2019, 22(10): 627-632.
|
| [4] |
WANG D Y, SALEM J E, COHEN J V, et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta-analysis[J]. JAMA Oncol, 2018, 4(12): 1721-1728.
[DOI]
|
| [5] |
MAHMOOD S S, FRADLEY M G, COHEN J V, et al. Myocarditis in patients treated with immune checkpoint inhibitors[J]. J Am Coll Cardiol, 2018, 71(16): 1755-1764.
[DOI]
|
| [6] |
中国抗癌协会整合肿瘤心脏病学分会, 中华医学会心血管病学分会肿瘤心脏病学学组, 中国医师协会心血管内科医师分会肿瘤心脏病学专业委员会, 等. 免疫检查点抑制剂相关心肌炎监测与管理中国专家共识(2020版)[J]. 中国肿瘤临床, 2020, 47(20): 1027-1038. Society of Integrative Cardio-Oncology China Anti-Cancer Association, The Cardio-Oncology Group of the Chinese Society of Cardiovascular Diseases of Chinese Medical Association, Chinese College of Cardiovascular Physicians Specialized Committee on Cardio-Oncology Chinese Medical Docotor Association, et al. Chinese expert consensus on the surveillance and management of immune checkpoint inhibitor-related myocarditis (2020 version)[J]. Chinese Journal of Clinical Oncology, 2020, 47(20): 1027-1038. [DOI] |
| [7] |
LYON A R, LÓPEZ-FERNÁNDEZ T, COUCH L S, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS): Developed by the task force on cardio-oncology of the European Society of Cardiology (ESC)[J]. European Heart Journal, 2022, 43(41): 4229-4361.
[DOI]
|
| [8] |
SALEM J E, MANOUCHEHRI A, MOEY M, et al. Cardiovascular toxicities associated with immune checkpoint inhibitors: an observational, retrospective, pharmacovigilance study[J]. Lancet Oncol, 2018, 19(12): 1579-1589.
[DOI]
|
| [9] |
MASTER S R, ROBINSON A, MILLS G M, et al. Cardiovascular complications of immune checkpoint inhibitor therapy[J]. J Clin Oncol, 2019, 37(15_suppl): 2568.
[DOI]
|
| [10] |
MOSLEHI J J, SALEM J E, SOSMAN J A, et al. Increased reporting of fatal immune checkpoint inhibitor-associated myocarditis[J]. Lancet, 2018, 391(10124): 933.
|
| [11] |
JOHNSON D B, BALKO J M, COMPTON M L, et al. Fulminant myocarditis with combination immune checkpoint blockade[J]. N Engl J Med, 2016, 375(18): 1749-1755.
[DOI]
|
| [12] |
HU J R, FLORIDO R, LIPSON E J, et al. Cardiovascular toxicities associated with immune checkpoint inhibitors[J]. Cardiovasc Res, 2019, 115(5): 854-868.
[DOI]
|
| [13] |
RUBIO-INFANTE N, RAMÍREZ-FLORES Y A, CASTILLO E C, et al. Cardiotoxicity associated with immune checkpoint inhibitor therapy: a meta-analysis[J]. Eur J Heart Fail, 2021, 23(10): 1739-1747.
[DOI]
|
| [14] |
MAKUNTS T, SAUNDERS I M, COHEN I V, et al. Myocarditis occurrence with cancer immunotherapy across indications in clinical trial and post-marketing data[J]. Sci Rep, 2021, 11(1): 17324.
[DOI]
|
| [15] |
OREN O, YANG E H, MOLINA J R, et al. Cardiovascular health and outcomes in cancer patients receiving immune checkpoint inhibitors[J]. Am J Cardiol, 2020, 125(12): 1920-1926.
[DOI]
|
| [16] |
ZAMAMI Y, NⅡMURA T, OKADA N, et al. Factors associated with immune checkpoint inhibitor-related myocarditis[J]. JAMA Oncol, 2019, 5(11): 1635-1637.
[DOI]
|
| [17] |
WANG D Y, OKOYE G D, NEILAN T G, et al. Cardiovascular toxicities associated with cancer immunotherapies[J]. Curr Cardiol Rep, 2017, 19(3): 21.
[DOI]
|
| [18] |
JAFFE A S, VASILE V C, MILONE M, et al. Diseased skeletal muscle: a noncardiac source of increased circulating concentrations of cardiac troponin T[J]. J Am Coll Cardiol, 2011, 58(17): 1819-1824.
[DOI]
|
| [19] |
PRADHAN R, NAUTIYAL A, SINGH S. Diagnosis of immune checkpoint inhibitor-associated myocarditis: a systematic review[J]. Int J Cardiol, 2019, 296: 113-121.
[DOI]
|
| [20] |
中国临床肿瘤学会指南工作委员会. 免疫检查点抑制剂相关的毒性管理指南(2021版)[M]. 北京: 人民卫生出版社, 2021. Chinese Society of Clinical Oncology (CSCO). Management of immune checkpoint inhibitor-related toxicity (2021 version)[M]. Beijing: People's Medical Publishing House, 2021. |
| [21] |
BONACA M P, OLENCHOCK B A, SALEM J E, et al. Myocarditis in the setting of cancer therapeutics: proposed case definitions for emerging clinical syndromes in cardio-oncology[J]. Circulation, 2019, 140(2): 80-91.
|
| [22] |
THOMPSON J A, SCHNEIDER B J, BRAHMER J, et al. Management of immunotherapy-related toxicities, version 1.2022, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2022, 20(4): 387-405.
[DOI]
|
| [23] |
HOA S, LAAOUAD L, ROBERTS J, et al. Preexisting autoimmune disease and immune-related adverse events associated with anti-PD-1 cancer immunotherapy: a national case series from the Canadian Research Group of Rheumatology in Immuno-Oncology[J]. Cancer Immunol Immunother, 2021, 70(8): 2197-2207.
[DOI]
|
| [24] |
VAN DER KOOIJ M K, SUIJKERBUIJK K P M, AARTS M J B, et al. Safety and efficacy of checkpoint inhibition in patients with melanoma and preexisting autoimmune disease: a cohort study[J]. Ann Intern Med, 2021, 174(5): 641-648.
[DOI]
|
| [25] |
BROWN L J, WEPPLER A, BHAVE P, et al. Combination anti-PD1 and ipilimumab therapy in patients with advanced melanoma and pre-existing autoimmune disorders[J]. J Immunother Cancer, 2021, 9(5): e002121.
[DOI]
|
| [26] |
TISON A, QUÉRÉ G, MISERY L, et al. Safety and efficacy of immune checkpoint inhibitors in patients with cancer and preexisting autoimmune disease: a nationwide, multicenter cohort study[J]. Arthritis Rheumatol, 2019, 71(12): 2100-2111.
[DOI]
|
| [27] |
ZHANG K, KONG X, LI Y, et al. PD-1/PD-L1 inhibitors in patients with preexisting autoimmune diseases[J]. Front Pharmacol, 2022, 13: 854967.
[DOI]
|
| [28] |
CORTELLINI A, BUTI S, SANTINI D, et al. Clinical outcomes of patients with advanced cancer and pre-existing autoimmune diseases treated with anti-programmed death-1 immunotherapy: a real-world transverse study[J]. Oncologist, 2019, 24(6): e327-e337.
[DOI]
|
| [29] |
MENZIES A M, JOHNSON D B, RAMANUJAM S, et al. Anti-PD-1 therapy in patients with advanced melanoma and preexisting autoimmune disorders or major toxicity with ipilimumab[J]. Ann Oncol, 2017, 28(2): 368-376.
[DOI]
|
| [30] |
KOSTINE M, FINCKH A, BINGHAM C O, et al. EULAR points to consider for the diagnosis and management of rheumatic immune-related adverse events due to cancer immunotherapy with checkpoint inhibitors[J]. Ann Rheum Dis, 2021, 80(1): 36-48.
[DOI]
|
| [31] |
ARBOUR K C, MEZQUITA L, LONG N, et al. Impact of baseline steroids on efficacy of programmed cell death-1 and programmed death-ligand 1 blockade in patients with non-small-cell lung cancer[J]. J Clin Oncol, 2018, 36(28): 2872-2878.
[DOI]
|
| [32] |
ZHANG C, CHEN Z, MO C, et al. Real-world cardiovascular toxicity of immune checkpoint inhibitors in cancer patients: a retrospective controlled cohort study[J]. Am J Cancer Res, 2021, 11(12): 6074-6085.
|
| [33] |
SPALLAROSSA P, TINI G, SAROCCHI M, et al. Identification and management of immune checkpoint inhibitor-related myocarditis: use troponin wisely[J]. J Clin Oncol, 2019, 37(25): 2201-2205.
[DOI]
|
| [34] |
PUZANOV I, SUBRAMANIAN P, YATSYNOVICH Y V, et al. Clinical characteristics, time course, treatment and outcomes of patients with immune checkpoint inhibitor-associated myocarditis[J]. J Immunother Cancer, 2021, 9(6): e002553.
[DOI]
|
| [35] |
DOLLADILLE C, EDERHY S, SASSIER M, et al. Immune checkpoint inhibitor rechallenge after immune-related adverse events in patients with cancer[J]. JAMA Oncol, 2020, 6(6): 865-871.
[DOI]
|
| [36] |
ESCUDIER M, CAUTELA J, MALISSEN N, et al. Clinical features, management, and outcomes of immune checkpoint inhibitor-related cardiotoxicity[J]. Circulation, 2017, 136(21): 2085-2087.
[DOI]
|
| [37] |
SHALATA W, ABU-SALMAN A, STECKBECK R, et al. Cardiac toxicity associated with immune checkpoint inhibitors: a systematic review[J]. Cancers (Basel), 2021, 13(20): 5218.
[DOI]
|
| [38] |
WANG F, SUN X C, QIN S K, et al. A retrospective study of immune checkpoint inhibitor-associated myocarditis in a single center in China[J]. Chin Clin Oncol, 2020, 9(2): 16.
[DOI]
|
| [39] |
MOSLEHI J, LICHTMAN A H, SHARPE A H, et al. Immune checkpoint inhibitor-associated myocarditis: manifestations and mechanisms[J]. J Clin Invest, 2021, 131(5): e145186.
[DOI]
|
| [40] |
Section of Precision Medical of Chinese Society of Cardiology of Chinese Medical Association, Editorial Board of Chinese Journal of Cardiology, Working Group on Adult Myocarditis. Chinese expert consensus statement on clinical diagnosis and treatment of fulminant myocarditis in adults[J]. Zhonghua Xin Xue Guan Bing Za Zhi, 2017, 45(9): 742-752.
|
| [41] |
CAFORIO A L, PANKUWEIT S, ARBUSTINI E, et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases[J]. Eur Heart J, 2013, 34(33): 2636-2648.
[DOI]
|
| [42] |
HEINZERLING L, OTT P A, HODI F S, et al. Cardiotoxicity associated with CTLA4 and PD1 blocking immunotherapy[J]. J Immunother Cancer, 2016, 4: 50.
[DOI]
|
| [43] |
林瑾仪, 王妍, 侯惠萍, 等. 软组织肉瘤患者可溶性ST2的临床价值: 一项单中心横断面研究[J]. 中国癌症杂志, 2020, 30(12): 996-1001. LIN J Y, WANG Y, HOU H P, et al. Clinical value of soluble ST2 in patients with soft tissue sarcomas: a single center cross-sectional study[J]. Chin Oncol, 2020, 30(12): 996-1001. [CNKI] |
| [44] |
ALHUMAID W, YOGASUNDARAM H, SENARATNE J M. Slow bidirectional ventricular tachycardia as a manifestation of immune checkpoint inhibitor myocarditis[J]. Eur Heart J, 2021, 42(29): 2868.
[DOI]
|
| [45] |
POWER J R, ALEXANDRE J, CHOUDHARY A, et al. Electrocardiographic manifestations of immune checkpoint inhibitor myocarditis[J]. Circulation, 2021, 144(18): 1521-1523.
[DOI]
|
| [46] |
ZLOTOFF D A, HASSAN M Z O, ZAFAR A, et al. Electrocardiographic features of immune checkpoint inhibitor associated myocarditis[J]. J Immunother Cancer, 2021, 9(3): e002007.
[DOI]
|
| [47] |
LØGSTRUP B B, NIELSEN J M, KIM W Y, et al. Myocardial oedema in acute myocarditis detected by echocardiographic 2D myocardial deformation analysis[J]. Eur Heart J Cardiovasc Imaging, 2016, 17(9): 1018-1026.
[DOI]
|
| [48] |
SKOURI H N, DEC G W, FRIEDRICH M G, et al. Noninvasive imaging in myocarditis[J]. J Am Coll Cardiol, 2006, 48(10): 2085-2093.
[DOI]
|
| [49] |
AWADALLA M, MAHMOOD S S, GROARKE J D, et al. Global longitudinal strain and cardiac events in patients with immune checkpoint inhibitor-related myocarditis[J]. J Am Coll Cardiol, 2020, 75(5): 467-478.
[DOI]
|
| [50] |
SHEN Y, ZHANG H, ZHANG Q, et al. Right ventricular ejection fraction assessed by three-dimensional echocardiography is associated with long-term adverse clinical cardiac events in patients with anthracycline-induced cardiotoxicity[J]. J Am Soc Echocardiogr, 2022, 35(6): 600-608.e3.
[DOI]
|
| [51] |
XU Y, SHI J, ZHAO R, et al. Anthracycline induced inconsistent left ventricular segmental systolic function variation in patients with lymphoma detected by three-dimensional speckle tracking imaging[J]. Int J Cardiovasc Imaging, 2019, 35(5): 771-779.
[DOI]
|
| [52] |
CADOUR F, CAUTELA J, RAPACCHI S, et al. Cardiac MRI features and prognostic value in immune checkpoint inhibitor-induced myocarditis[J]. Radiology, 2022, 303(3): 512-521.
[DOI]
|
| [53] |
KRAMER C M, HANSON C A. CMR parametric mapping in immune checkpoint inhibitor myocarditis: novel noninvasive tools in a lethal condition[J]. J Am Coll Cardiol, 2021, 77(12): 1517-1519.
[DOI]
|
| [54] |
BOUGHDAD S, LATIFYAN S, FENWICK C, et al. 68Ga-DOTATOC PET/CT to detect immune checkpoint inhibitor-related myocarditis[J]. J Immunother Cancer, 2021, 9(10): e003594.
[DOI]
|
| [55] |
FINKE D, HECKMANN M B, HERPEL E, et al. Early detection of checkpoint inhibitor-associated myocarditis using 68Ga-FAPI PET/CT[J]. Front Cardiovasc Med, 2021, 8: 614997.
[DOI]
|
| [56] |
CHEN W, JEUDY J. Assessment of myocarditis: cardiac MR, PET/CT, or PET/MR?[J]. Curr Cardiol Rep, 2019, 21(8): 76.
[DOI]
|
| [57] |
KOELZER V H, ROTHSCHILD S I, ZIHLER D, et al. Systemic inflammation in a melanoma patient treated with immune checkpoint inhibitors-an autopsy study[J]. J Immunother Cancer, 2016, 4: 13.
[DOI]
|
| [58] |
SCHNEIDER B J, NAIDOO J, SANTOMASSO B D, et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: ASCO guideline update[J]. J Clin Oncol, 2021, 39(36): 4073-4126.
[DOI]
|
| [59] |
VERONESE G, AMMIRATI E. Differences in clinical presentation and outcome between immune checkpoint inhibitor-associated myocarditis and classical acute myocarditis: same disease, distinct challenges to face[J]. Int J Cardiol, 2019, 296: 124-126.
[DOI]
|
| [60] |
THOMPSON J A, SCHNEIDER B J, BRAHMER J, et al. NCCN guidelines insights: management of immunotherapy-related toxicities, version 1.2020[J]. J Natl Compr Canc Netw, 2020, 18(3): 230-241.
[DOI]
|
| [61] |
BALL S, GHOSH R K, WONGSAENGSAK S, et al. Cardiovascular toxicities of immune checkpoint inhibitors: JACC review topic of the week[J]. J Am Coll Cardiol, 2019, 74(13): 1714-1727.
[DOI]
|
| [62] |
WANG C, LIN J, WANG Y, et al. Case series of steroid-resistant immune checkpoint inhibitor associated myocarditis: a comparative analysis of corticosteroid and tofacitinib treatment[J]. Front Pharmacol, 2021, 12: 770631.
[DOI]
|
| [63] |
LYON A R, LÓPEZ-FERNÁNDEZ T, COUCH L S, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS)[J]. Eur Heart J, 2022, 43(41): 4229-4361.
[DOI]
|
| [64] |
ZHANG L, ZLOTOFF D A, AWADALLA M, et al. Major adverse cardiovascular events and the timing and dose of corticosteroids in immune checkpoint inhibitor-associated myocarditis[J]. Circulation, 2020, 141(24): 2031-2034.
[DOI]
|
| [65] |
CAUTELA J, ZERIOUH S, GAUBERT M, et al. Intensified immunosuppressive therapy in patients with immune checkpoint inhibitor-induced myocarditis[J]. J Immunother Cancer, 2020, 8(2): e001887.
[DOI]
|
| [66] |
GUO C W, ALEXANDER M, DIB Y, et al. A closer look at immune-mediated myocarditis in the era of combined checkpoint blockade and targeted therapies[J]. Eur J Cancer, 2020, 124: 15-24.
[DOI]
|
| [67] |
MAHMOOD S S, CHEN C L, SHAPNIK N, et al. Myocarditis with tremelimumab plus durvalumab combination therapy for endometrial cancer: a case report[J]. Gynecol Oncol Rep, 2018, 25: 74-77.
[DOI]
|
| [68] |
LEHMANN L H, CAUTELA J, PALASKAS N, et al. Clinical strategy for the diagnosis and treatment of immune checkpoint inhibitor-associated myocarditis: a narrative review[J]. JAMA Cardiol, 2021, 6(11): 1329-1337.
[DOI]
|
| [69] |
KWON H J, COTÉ T R, CUFFE M S, et al. Case reports of heart failure after therapy with a tumor necrosis factor antagonist[J]. Ann Intern Med, 2003, 138(10): 807-811.
[DOI]
|
| [70] |
DOMS J, PRIOR J O, PETERS S, et al. Tocilizumab for refractory severe immune checkpoint inhibitor-associated myocarditis[J]. Ann Oncol, 2020, 31(9): 1273-1275.
[DOI]
|
| [71] |
ESFAHANI K, BUHLAIGA N, THÉBAULT P, et al. Alemtuzumab for immune-related myocarditis due to PD-1 therapy[J]. N Engl J Med, 2019, 380(24): 2375-2376.
[DOI]
|
| [72] |
TAY R Y, BLACKLEY E, MCLEAN C, et al. Successful use of equine anti-thymocyte globulin (ATGAM) for fulminant myocarditis secondary to nivolumab therapy[J]. Br J Cancer, 2017, 117(7): 921-924.
[DOI]
|
| [73] |
SALEM J E, ALLENBACH Y, VOZY A, et al. Abatacept for severe immune checkpoint inhibitor-associated myocarditis[J]. N Engl J Med, 2019, 380(24): 2377-2379.
[DOI]
|
| [74] |
GOLAND S, CZER L S C, SIEGEL R J, et al. Intravenous immunoglobulin treatment for acute fulminant inflammatory cardiomyopathy: series of six patients and review of literature[J]. Can J Cardiol, 2008, 24(7): 571-574.
[DOI]
|
| [75] |
MAISCH B, RUPPERT V, PANKUWEIT S. Management of fulminant myocarditis: a diagnosis in search of its etiology but with therapeutic options[J]. Curr Heart Fail Rep, 2014, 11(2): 166-177.
[DOI]
|
| [76] |
ZHANG H, LIN J Y, SHEN Y H, et al. Protective effect of crocin on immune checkpoint inhibitors-related myocarditis through inhibiting NLRP3 mediated pyroptosis in cardiomyocytes via NF-κB pathway[J]. J Inflamm Res, 2022, 15: 1653-1666.
[DOI]
|
| [77] |
QIN B D, JIAO X D, ZHOU X C, et al. Effects of concomitant proton pump inhibitor use on immune checkpoint inhibitor efficacy among patients with advanced cancer[J]. Oncoimmunology, 2021, 10(1): 1929727.
[DOI]
|
| [78] |
TAJMIR-RIAHI A, BERGMANN T, SCHMID M, et al. Life-threatening autoimmune cardiomyopathy reproducibly induced in a patient by checkpoint inhibitor therapy[J]. J Immunother, 2018, 41(1): 35-38.
[DOI]
|
| [79] |
NORWOOD T G, WESTBROOK B C, JOHNSON D B, et al. Smoldering myocarditis following immune checkpoint blockade[J]. J Immunother Cancer, 2017, 5(1): 91.
[DOI]
|
| [80] |
LIU Q, YU Y, LIN J, et al. Treatment strategy for myocarditis in patients using immune checkpoint inhibitors or combined anti-vascular endothelial growth factor therapy by clinical severity[J]. Eur J Cancer, 2021, 157: 10-20.
[DOI]
|
| [81] |
SHANKAR B, ZHANG J, NAQASH A R, et al. Multisystem immune-related adverse events associated with immune checkpoint inhibitors for treatment of non-small cell lung cancer[J]. JAMA Oncol, 2020, 6(12): 1952-1956.
[DOI]
|
| [82] |
HUSSAINI S, CHEHADE R, BOLDT R G, et al. Association between immune-related side effects and efficacy and benefit of immune checkpoint inhibitors - A systematic review and meta-analysis[J]. Cancer Treat Rev, 2021, 92: 102134.
[DOI]
|
| [83] |
ALLOUCHERY M, LOMBARD T, MARTIN M, et al. Safety of immune checkpoint inhibitor rechallenge after discontinuation for grade ≥2 immune-related adverse events in patients with cancer[J]. J Immunother Cancer, 2020, 8(2): e001622.
[DOI]
|
| [84] |
BALANESCU D V, DONISAN T, PALASKAS N, et al. Immunomodulatory treatment of immune checkpoint inhibitor-induced myocarditis: pathway toward precision-based therapy[J]. Cardiovasc Pathol, 2020, 47: 107211.
[DOI]
|
| [85] |
PELEG HASSON S, SALWEN B, SIVAN A, et al. Re-introducing immunotherapy in patients surviving immune checkpoint inhibitors-mediated myocarditis[J]. Clin Res Cardiol, 2021, 110(1): 50-60.
[DOI]
|
| [86] |
BRAHMER J R, LACCHETTI C, SCHNEIDER B J, et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: American society of clinical oncology clinical practice guideline[J]. J Clin Oncol, 2018, 36(17): 1714-1768.
[DOI]
|
| [87] |
CURIGLIANO G, LENIHAN D, FRADLEY M, et al. Management of cardiac disease in cancer patients throughout oncological treatment: ESMO consensus recommendations[J]. Ann Oncol, 2020, 31(2): 171-190.
[DOI]
|
 2023, Vol. 30
2023, Vol. 30


