肿瘤的发生、发展、复发、转移及预后都与细胞的代谢异常密切相关。细胞增殖是所有肿瘤的共同特征,需要脂质合成细胞膜和信号分子。肿瘤细胞出现脂类代谢异常可能导致细胞膜结构、能量稳态、细胞信号、基因表达和蛋白质分布受到破坏,从而影响细胞功能,包括细胞的增殖、凋亡、自噬、分化及抗药性等一系列生物学过程[1]。因此,脂代谢紊乱在肿瘤的发生发展中起着重要作用。
脂质代谢异常与多种疾病如恶性肿瘤的发生存在关联。Han等[2]首先提出了“脂质组学”这一概念。Chen等[3]采用超高效液相色谱-离子阱飞行时间质谱检测了健康人、乙型肝炎患者、肝硬化患者、肝癌患者的血清脂质,找到了75种差异脂质代谢物,包括溶血磷脂酰胆碱(LPC)、磷脂酰胆碱(PC)和鞘磷脂(SM)等。前列腺癌患者血清中也发现磷脂水平尤其是LPC和磷脂酰乙醇胺(PE)的含量显著低于正常人[4]。此外,恶性肿瘤的发生、发展与机体免疫系统功能状态密切相关[5]。肿瘤患者常伴有免疫抑制或免疫功能受损,肿瘤免疫的效应主要是通过细胞免疫或体液免疫发挥作用[6]。肿瘤微环境(TME)中常见的脂质积聚代谢改变,被认为是免疫细胞功能障碍的关键因素[7]。血清免疫细胞亚群及细胞因子的水平一定程度上能反映患者免疫状态。本研究通过测定肿瘤患者血清脂代谢指标水平的变化,分析其与免疫细胞亚群、细胞因子水平的相关性,初步揭示脂质组学与肿瘤免疫功能状态之间的潜在关系。
1 资料与方法 1.1 研究对象选取2018年7月至2021年4月在复旦大学附属金山医院肿瘤科就诊的214例肿瘤患者为研究组,同期选取该院105例非肿瘤人群为对照组。纳入标准为复旦大学附属金山医院确诊的肿瘤患者,排除合并心血管、内分泌等代谢异常。本研究通过复旦大学附属金山医院伦理委员会批准(JIEC 2021-S14),所有患者知情并签署知情同意书。
1.2 脂质组学分析 1.2.1 样本收集与脂质提取采集患者空腹静脉血,提取上层血清储存至﹣80℃冰箱中待进一步分析。样品检测前,取出20 μL血清和已预冷至4℃的350 μL异丙醇和Internal Standards Kit for LipidyzerTM Platform中各1 μL的标准品混匀后,在室温孵育10 min,将该混合物在﹣20℃条件下静置12 h。13 300×g离心20 min,取上清200 μL于样品管中,﹣80℃保存,等待质谱分析。
1.2.2 色谱条件与质谱检测采用AB SCIEX QTRAP 5500 LC-MS/MS检测血清脂质组。提取的样品用Waters Acquity UPLC BEH HILIC VanGuard前柱(2.1 mm×5 mm,1.7 μm),注入Waters Acquity UPLC BEH HILIC柱(100 mm×2.1 mm,1.7 μm)。流动相为95/5(V/V)的乙腈/去离子水(溶剂A),50/50(V/V)的乙腈/去离子水(溶剂B)。向B相中加入氢氧化铵,直至pH与A相pH相等,流速0.5 mL/min。进行梯度洗脱,B相使用10 min由0.1% 增加到20%,然后用10 min增加到98%,B相以98%保持2 min,并用13.1 min返回到初始条件0.1%。B相以0.1%保持16 min。正离子电喷雾电离(ESI+)模式注入体积是2 μL,和负离子电喷雾电离(ESI-)模式注入体积是5 μL。以N2为溶剂。参数设置如下:帘气(curtain gas)35 psi(1 psi=6.895 kPa)、GS 150 psi、GS 260 psi、离子喷雾电压5 500 V、去簇电压80 V、入口能量10 V、碰撞能量50 V。
1.2.3 数据预处理采用Analyst软件(AB SCIEX公司)采集数据,测得的原始数据导入OS-MQ软件,进行峰匹配对齐和峰提取操作。根据已知的内标化合物浓度和峰面积对代谢物进行定量计算,得到各指标的浓度。
1.3 免疫功能指标检测取新鲜抗凝全血于1.5 mL离心管,离心后加入6倍细胞沉淀体积的红细胞裂解液进行裂解,裂解后用1×PBS清洗1次,194×g,5 min,离心后获得细胞沉淀;向细胞沉淀中加入50 μL抗体混合液(抗体∶PBS=1∶200),染色条件为室温避光15 min;染色后用1×PBS清洗1次,194×g,5 min;离心获得细胞沉淀后加入500 μL 1×PBS重悬细胞至流式进样管内。上机之前用300~400目的滤网过滤,过滤后避光放置冰上等待检测。用流式细胞仪(BD公司,美国)分析检测细胞。
数据预处理:获得原始数据用FlowJo V10分析软件以及GraphPad Prism 8.0进行分析处理。
1.4 统计学处理采用SPSS 23.0、SIMCA 14.1和R 3.5.1统计学软件进行统计分析。符合正态分布的计量资料以x±s表示,组间比较采用t检验。应用正交偏最小二乘判别分析(OPLS-DA)、Permutation置换检验进行多元分析。
2 结果 2.1 人口学特征及一般资料研究组共包括14种类型肿瘤(图 1),其中男性134例(62.62%),年龄41~81岁;对照组中男性52例(49.52%),年龄21~81岁。研究组与对照组的年龄及临床生化指标差异均存在统计学意义(P<0.001,表 1)。
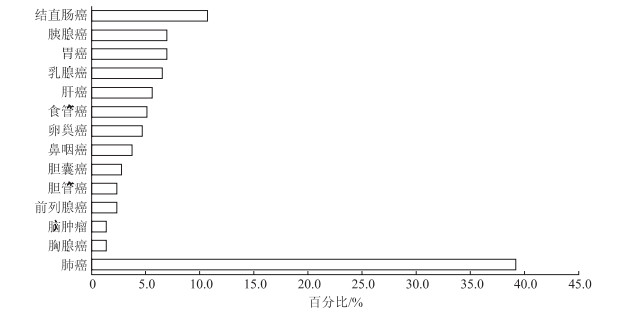
|
| 图 1 研究组癌种分类 |
| 指标 | 研究组 (n=214) |
对照组 (n=105) |
P值 |
| 年龄/岁 | 64.77±10.47 | 49.06±15.33 | <0.001 |
| 甲胎蛋白/(ng•mL﹣1) | 50.4±1.1 | 2.0±0.9 | <0.001 |
| 癌胚抗原/(ng•mL﹣1) | 54.5±27.0 | 1.3±0.6 | <0.001 |
| 糖类抗原125/(U•mL﹣1) | 49.7±36.0 | 6.9±2.5 | <0.001 |
| 糖类抗原153/(U•mL﹣1) | 60.1±32.6 | 11.7±1.1 | <0.001 |
| 糖类抗原199/(U•mL﹣1) | 207.8±23.2 | 4.2±1.9 | <0.001 |
| 三酰甘油/(mmol•L﹣1) | 1.8±0.3 | 1.0±0.2 | <0.001 |
| 总胆固醇/(mmol•L﹣1) | 4.7±1.1 | 3.2±0.9 | <0.001 |
| 高密度脂蛋白/(mmol•L﹣1) | 1.1±0.4 | 1.2±0.1 | 0.005 |
| 低密度脂蛋白/(mmol•L﹣1) | 3.0±0.9 | 1.8±1.0 | <0.001 |
| 载脂蛋白A-C/(g•L﹣1) | 4.0±0.1 | 3.1±0.1 | <0.001 |
| 载脂蛋白B/(g•L﹣1) | 0.9±0.3 | 0.6±0.5 | <0.001 |
| 脂蛋白a/(g•L﹣1) | 270.6±101.0 | 101.7±36.1 | <0.001 |
基于靶向LC-MS/MS分析319例血清样本,共定量780种脂质,其中530种脂质采用正离子模式测定,250种脂质采用负离子模式测定。定量脂质类别共计9类,分别为LPC、PC、溶血磷脂酰乙醇胺(LPE)、PE、胆固醇酯(CE)、二酰甘油(DAG)、SM和三酰甘油(TAG)。运用多变量统计分析的方法对数据进行模式判别分析。研究组和对照组的OPLS-DA得分见图 2A。研究组和对照组OPLS-DA模型的置换检验见图 2B,Q2回归直线与Y轴的截距为﹣0.331。结果表明OPLS-DA模型无过拟合现象,OPLS-DA模型可靠。
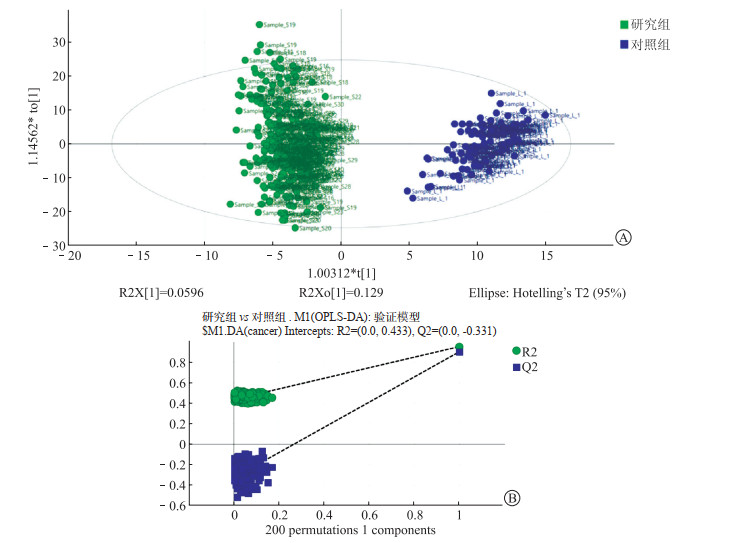
|
| 图 2 两组患者OPLS-DA得分及模型验证 A:OPLS-DA得分图;B:OPLS-DA置换检验图。 |
筛选血清中780个脂质分子。受试者工作特征(ROC)曲线下面积(AUC)值可评估潜在脂质分子预测疾病的能力,AUC值越接近1其诊断能力越高,AUC>0.7表示具有一定的诊断价值;而AUC>0.9则认为对疾病的诊断效能非常高,可作为潜在生物标志物进入下一步研究。Fold Change(FC)为两组样本脂质分子含量的差异倍数。研究组与对照组以AUC>0.7、|FC|>1、P<0.05标准共筛选出37个差异脂质分子(表 2、图 3)。
| 指标 | AUC | FC | P值 | 指标 | AUC | FC | P值 | |
| CE(16:0) | 0.71 | 1.49 | <0.001 | PE(14:0/14:0)-H | 0.89 | ﹣1.81 | <0.001 | |
| DAG(14:0/14:0) | 0.76 | ﹣1.22 | <0.001 | PE(14:0/16:1) | 0.86 | ﹣1.09 | <0.001 | |
| DAG(14:0/16:1) | 0.75 | ﹣1.30 | <0.001 | PE(14:0/18:3) | 0.88 | ﹣1.56 | <0.001 | |
| DAG(14:0/20:0) | 0.71 | ﹣1.03 | <0.001 | PE(14:0/20:1) | 0.83 | ﹣1.34 | <0.001 | |
| DAG(14:0/20:4) | 0.81 | ﹣1.13 | <0.001 | PE(14:0/20:2) | 0.83 | ﹣1.37 | <0.001 | |
| DAG(14:0/22:6) | 0.80 | ﹣1.01 | <0.001 | PE(14:0/20:5) | 0.87 | ﹣1.53 | <0.001 | |
| DAG(16:0/16:1) | 0.72 | ﹣1.00 | <0.001 | PE(16:0/14:0) | 0.91 | ﹣1.42 | <0.001 | |
| DAG(16:0/20:3) | 0.75 | ﹣1.21 | <0.001 | PE(18:0/14:0) | 0.87 | ﹣1.23 | <0.001 | |
| DAG(16:0/22:5) | 0.73 | ﹣1.04 | <0.001 | SM(14:0) | 0.85 | ﹣1.21 | <0.001 | |
| LPE(14:0) | 0.95 | ﹣2.10 | <0.001 | SM(16:0) | 0.85 | ﹣1.19 | <0.001 | |
| PC(14:0/22:4) | 0.79 | 1.28 | <0.001 | SM(22:0) | 0.91 | ﹣1.31 | <0.001 | |
| PC(16:0/14:0) | 0.89 | 1.19 | <0.001 | SM(22:1) | 0.90 | ﹣1.31 | <0.001 | |
| PC(16:0/16:0) | 0.89 | 1.11 | <0.001 | SM(24:0) | 0.90 | ﹣1.27 | <0.001 | |
| PC(16:0/16:1) | 0.91 | 1.26 | <0.001 | SM(24:1) | 0.84 | ﹣1.04 | <0.001 | |
| PC(18:0/16:1) | 0.87 | 1.03 | <0.001 | SM(26:0) | 0.85 | ﹣1.06 | <0.001 | |
| PC(18:0/22:4) | 0.89 | 1.05 | <0.001 | TAG(42:0)-FA(16:0) | 0.87 | ﹣1.03 | <0.001 | |
| PC(18:0/22:6) | 0.89 | 1.04 | <0.001 | TAG(44:0)-FA(18:0) | 0.94 | ﹣1.60 | <0.001 | |
| PC(18:1/22:4) | 0.89 | 1.13 | <0.001 | TAG(46:3)-FA(18:3) | 0.93 | ﹣1.70 | <0.001 | |
| PC(18:2/18:3) | 0.75 | 1.02 | <0.001 | |||||
| PC:磷脂酰胆碱;LPE:溶血磷脂酰乙醇胺;PE:磷脂酰乙醇胺;CE:胆固醇酯;DAG:二酰甘油;SM:鞘磷脂;TAG:三酰甘油;FA:脂肪酸;AUC:曲线下面积;FC:差异倍数。 | ||||||||
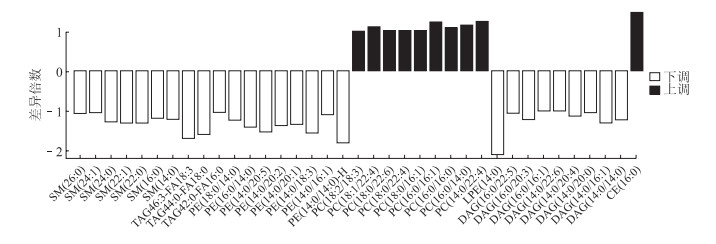
|
| 图 3 Fold Change筛选研究组和对照组主要差异脂质代谢物 |
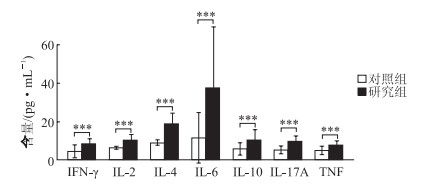
结果(图 4、图 5)显示:12种免疫细胞和7种免疫细胞因子在研究组和对照组之间差异有统计学意义。
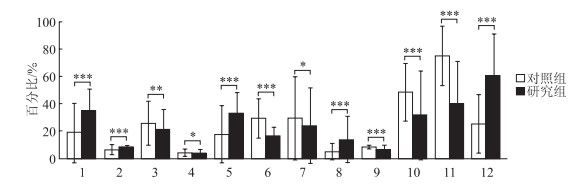
|
| 图 4 两组人群免疫细胞亚群差异分析 1: 幼稚CD8+T细胞; 2: 中央记忆CD8+T细胞; 3: 效应CD8+T细胞; 4: 效应CD4+T细胞; 5: 幼稚CD4+T细胞; 6: Th1细胞; 7: Th2细胞; 8: Th17细胞; 9: 调节性T细胞; 10: CD16+NK细胞; 11: 记忆调节性T细胞; 12: 幼稚调节性T细胞。*P<0.05, **P<0.01, ***P<0.001;n=3, x±s。 |
|
| 图 5 两组人群免疫细胞因子差异分析 IFN-γ: 干扰素γ;IL-2:白细胞介素2;IL-4:白细胞介素4;IL-6:白细胞介素6;IL-10:白细胞介素10;IL-17A:白细胞介素17A;TNF:肿瘤坏死因子。***P<0.001; n=3, x±s。 |
Spearman相关性分析结果(图 6)显示,肿瘤患者血清中PC、PE、CE、DAG、SM和TAG与中央记忆CD8+T细胞、Th1细胞、Th2细胞、调节性T细胞、幼稚调节性T细胞、记忆调节性T细胞和CD16+NK细胞数量的相关性趋势一致,均为与中央记忆CD8+T细胞、Th2细胞、调节性T细胞、记忆调节性T细胞和CD16+NK细胞数量正相关,与Th1细胞和幼稚调节性T细胞负相关;LPE与效应CD8+T细胞和Th1细胞正相关,与Th2细胞数量负相关。Th1细胞和所有差异脂质分子的相关性均与Th2细胞的相反,幼稚调节性T细胞和所有差异脂质分子的相关性与记忆调节性T细胞呈现出相反的趋势。

|
| 图 6 脂质分子与肿瘤患者血清淋巴细胞亚群数量相关性 *P<0.05, **P<0.01。 |
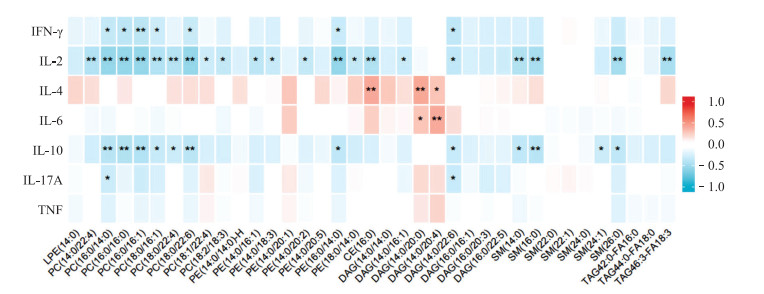
Spearman相关性分析结果(图 7)显示,肿瘤患者血清中部分PC、PE、DAG、SM和TAG类脂质分子与白细胞介素(IL)-2和IL-10负相关;CE和部分DAG类与IL-4和IL-6负相关。肿瘤坏死因子(TNF)与所有脂质分子均无明显相关性。
|
| 图 7 脂质分子与肿瘤患者血清免疫细胞因子水平相关性 IFN-γ: 干扰素γ;IL-2:白细胞介素2;IL-4:白细胞介素4;IL-6:白细胞介素6;IL-10:白细胞介素10;IL-17A:白细胞介素17A;TNF:肿瘤坏死因子。*P<0.05, **P<0.01。 |
脂质是细胞膜基本的组成物质,在信号传递中发挥关键作用,是分子和许多细胞功能的调节器。然而,肿瘤细胞与肿瘤微环境中的其他类型细胞也会利用各种途径获取脂质并进行代谢重编程,促进前馈致癌信号,抗氧化应激,调节细胞间交流和免疫反应等[8]。
甘油磷脂是含量最丰富的脂类,也是生物膜的主要成分[9]。PC和PE是哺乳动物细胞中含量最丰富的磷脂类物质,在多种疾病的发展过程中表现出明显的变化[10]。PE可经磷脂酰乙醇胺N-甲基转移酶转变为PC,磷脂酰乙醇胺N-甲基转移酶在非小细胞肺癌患者中的表达显著上调,对短生存期和不良预后具有指示意义,因此激活状态的PC代谢通路对肿瘤的发生发展具有重要作用[11]。在卵巢癌等肿瘤中,PC的变化提示其相关代谢酶有可能通过雌激素及其受体起作用,主要机制源于合成PC通路中酶的变化[12-13]。PC在免疫系统中的作用体现在活化的B细胞中,研究证明其为B细胞和抗体分泌细胞产生所必需[14]。
本研究中,肿瘤患者血清中的PC上调与PE下调提示可能是磷脂酰乙醇胺N-甲基转移酶在肿瘤患者中表达升高,促进PE更多地转变为PC。此外,PC和Th1细胞的相关性均与Th2细胞的相反,PC和幼稚调节性T细胞的相关性同样也与记忆调节性T细胞呈现出相反的趋势,提示淋巴细胞不同的分化、生长阶段可能与PC存在促进或抑制作用。胆固醇在血液或组织中的主要储存形式是CE,虽然胆固醇已被证明与几种类型的癌症有关,但CE是癌症进展的主要原因,而非胆固醇。CE不仅可以促进非酒精性脂肪肝病发展为肝细胞癌,而且在鼻咽癌的预后中也发挥重要作用[15-16]。这一发现与本研究中CE上调的结果相一致,提示CE不仅可以在肝癌和鼻咽癌中起到指示作用,还可在肺癌、结直肠癌以及胃癌等其他肿瘤中有更多的应用价值。此外,CE的积累对于维持人类T细胞的增殖是必不可少的[17]。
本研究中,CE在幼稚调节性T细胞分化为记忆调节性T细胞的过程中由负相关转变为正相关,提示CE的积累对于维持人类T细胞的分化存在一定程度的影响。TAG是由甘油和3个脂肪酸分子衍生而来,与肺癌、结肠癌、甲状腺癌、子宫内膜癌及乳腺癌等多种肿瘤的发生与死亡有关。TAG代谢障碍将会产生促癌效应,其机制源于脂肪三酰甘油脂肪酶(ATGL)的表达减少以及蛋白激酶(AMPK)信号转导的改变[18-22]。其中ATGL几乎被所有免疫细胞表达[23]。在肿瘤患者Ⅰ~Ⅳ期发展过程中,血清中TAG水平呈现逐渐上升趋势[24]。
综上所述,肿瘤患者体内由于代谢异常,导致脂类合成异常,进而使生物体内的脂质稳态发生改变。脂质代谢重编程与机体免疫功能密切相关,解析肿瘤免疫代谢调控机制将为寻找新的肿瘤治疗方法提供有前景的方向。然而,肿瘤外周血中各类脂代谢物对于免疫细胞分化、活化、功能中的作用研究还亟待加强。未来的研究需要在不同类型肿瘤中确定更多关键脂类、脂质分子,以及相关代谢基因、酶的表达异常与多种肿瘤发生发展的关系,进而为肿瘤预防、诊断、治疗及机制研究提供新的思路。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
HUANG C, FRETER C. Lipid metabolism, apoptosis and cancer therapy[J]. Int J Mol Sci, 2015, 16(1): 924-949.
[DOI]
|
| [2] |
HAN X, GROSS R W. Global analyses of cellular lipidomes directly from crude extracts of biological samples by ESI mass spectrometry: a bridge to lipidomics[J]. J Lipid Res, 2003, 44(6): 1071-1079.
[DOI]
|
| [3] |
CHEN S, YIN P, ZHAO X, et al. Serum lipid profiling of patients with chronic hepatitis B, cirrhosis, and hepatocellular carcinoma by ultra fast LC/IT-TOF MS[J]. Electrophoresis, 2013, 34(19): 2848-2856.
|
| [4] |
CVETKOVIĆ B, VUČIĆ V, CVETKOVIĆ Z, et al. Systemic alterations in concentrations and distribution of plasma phospholipids in prostate cancer patients[J]. Med Oncol, 2012, 29(2): 809-814.
[DOI]
|
| [5] |
PULENDRAN B, DAVIS M M. The science and medicine of human immunology[J]. Science, 2020, 369(6511): eaay4014.
[DOI]
|
| [6] |
王俞, 崔书中. 恶性肿瘤患者的免疫功能状态及免疫治疗研究进展[J]. 中国肿瘤临床, 2014, 41(13): 876-879. WANG Y, CUI S Z. Research progress in immune function of patients with malignant tumors and immunotherapy for cancers[J]. Chin J Clin Oncol, 2014, 41(13): 876-879. [DOI] |
| [7] |
XU S, CHAUDHARY O, RODRíGUEZ-MORALES P, et al. Uptake of oxidized lipids by the scavenger receptor CD36 promotes lipid peroxidation and dysfunction in CD8(+) T cells in tumors[J]. Immunity, 2021, 54(7): 1561-1577. e7.
[DOI]
|
| [8] |
BUTLER L M, PERONE Y, DEHAIRS J, et al. Lipids and cancer: emerging roles in pathogenesis, diagnosis and therapeutic intervention[J]. Adv Drug Deliv Rev, 2020, 159: 245-293.
[DOI]
|
| [9] |
LIU Z, HUANG X. Lipid metabolism in Drosophila: development and disease[J]. Acta Biochim Biophys Sin (Shanghai), 2013, 45(1): 44-50.
[DOI]
|
| [10] |
WANG R, LI B, LAM S M, et al. Integration of lipidomics and metabolomics for in-depth understanding of cellular mechanism and disease progression[J]. J Genet Genomics, 2020, 47(2): 69-83.
[DOI]
|
| [11] |
ZINRAJH D, HÖRL G, JÜRGENS G, et al. Increased phosphatidylethanolamine N-methyltransferase gene expression in non-small-cell lung cancer tissue predicts shorter patient survival[J]. Oncol Lett, 2014, 7(6): 2175-2179.
[DOI]
|
| [12] |
GRANATA A, NICOLETTI R, TINAGLIA V, et al. Choline kinase-alpha by regulating cell aggressiveness and drug sensitivity is a potential druggable target for ovarian cancer[J]. Br J Cancer, 2014, 110(2): 330-340.
[DOI]
|
| [13] |
TROUSIL S, LEE P, PINATO D J, et al. Alterations of choline phospholipid metabolism in endometrial cancer are caused by choline kinase alpha overexpression and a hyperactivated deacylation pathway[J]. Cancer Res, 2014, 74(23): 6867-6877.
[DOI]
|
| [14] |
BREWER J W, SOLODUSHKO V, ARAGON I, et al. Phosphatidylcholine as a metabolic cue for determining B cell fate and function[J]. Cell Immunol, 2016, 310: 78-88.
[DOI]
|
| [15] |
LIU D, WONG C C, FU L, et al. Squalene epoxidase drives NAFLD-induced hepatocellular carcinoma and is a pharmaceutical target[J]. Sci Transl Med, 2018, 10(437): eaap9840.
[DOI]
|
| [16] |
LI L, ZHANG Q, WANG X, et al. Squalene epoxidase-induced cholesteryl ester accumulation promotes nasopharyngeal carcinoma development by activating PI3K/AKT signaling[J]. Cancer Sci, 2020, 111(7): 2275-2283.
[DOI]
|
| [17] |
BÖRTLEIN C, SCHUMACHER F, KLEUSER B, et al. Role of neutral sphingomyelinase-2 (NSM 2) in the control of T cell plasma membrane lipid composition and cholesterol homeostasis[J]. Front Cell Dev Biol, 2019, 7: 226.
[DOI]
|
| [18] |
ARAI R, SODA S, OKUTOMI T, et al. Lipid accumulation in peripheral blood dendritic cells and anticancer immunity in patients with lung cancer[J]. J Immunol Res, 2018, 2018: 5708239.
|
| [19] |
LIN Y L, CHIANG J K, LIN S M, et al. Helicobacter pylori infection concomitant with metabolic syndrome further increase risk of colorectal adenomas[J]. World J Gastroenterol, 2010, 16(30): 3841-3846.
[DOI]
|
| [20] |
KRISHNADAS R, MCLEAN J, BATTY G D, et al. Cardio-metabolic risk factors and cortical thickness in a neurologically healthy male population: results from the psychological, social and biological determinants of ill health (pSoBid) study[J]. Neuroimage Clin, 2013, 2: 646-657.
[DOI]
|
| [21] |
TELLI O, SARICI H, EKICI M, et al. Does metabolic syndrome or its components associate with prostate cancer when diagnosed on biopsy?[J]. Ther Adv Med Oncol, 2015, 7(2): 63-67.
[DOI]
|
| [22] |
ZAGANI R, EL-ASSAAD W, GAMACHE I, et al. Inhibition of adipose triglyceride lipase (ATGL) by the putative tumor suppressor G0S2 or a small molecule inhibitor attenuates the growth of cancer cells[J]. Oncotarget, 2015, 6(29): 28282-28295.
[DOI]
|
| [23] |
SCHLAGER S, GOERITZER M, JANDL K, et al. Adipose triglyceride lipase acts on neutrophil lipid droplets to regulate substrate availability for lipid mediator synthesis[J]. J Leukoc Biol, 2015, 98(5): 837-850.
[DOI]
|
| [24] |
ARTHUR R, MØLLER H, GARMO H, et al. Association between baseline serum glucose, triglycerides and total cholesterol, and prostate cancer risk categories[J]. Cancer Med, 2016, 5(6): 1307-1318.
[DOI]
|
 2023, Vol. 30
2023, Vol. 30


