危及器官(organ at risk, OAR)的自动勾画在放疗领域得到了越来越多的研究和应用[1-4]。Sahiner等[5]发现,与其他器官相比,前列腺、胰腺等器官的自动勾画效果较差。放射治疗计划的优化和计划质量的评估涉及OAR,较差的自动勾画将导致不同程度的剂量变化[6],引起放疗不良反应。在自动勾画OAR对应的剂量评估参数(dose evaluation parameter, DEP)符合临床要求[7-10]的前提下,如果自动勾画的OAR对应的DEP等于或大于手动勾画OAR对应的DEP,那么手动勾画OAR的DEP也符合临床要求,此时自动勾画技术可以安全用于放疗。
将OAR的轮廓进行外扩对于确保自动勾画的OAR对应的DEP大于或等于手动勾画OAR对应的DEP是一种可行且常见的操作,但是这一操作可能导致外扩后较大的结构对应的DEP发生变化。本研究探讨将自动勾画的OAR进行不同程度外扩后,对其各DEP的影响,以及满足自动勾画安全应用于放疗所需要的最小外扩距离。
1 资料与方法 1.1 一般资料选择2019年至2021年复旦大学附属中山医院放疗科收治的接受过上腹部放疗的患者50例,主要治疗部位为胰腺、后腹膜淋巴结、门静脉等,靶区处方剂量为4 500~6 000 cGy。所有患者的CT图像均采用仰卧位-头先进(head first supine,HFS)方式,由西门子模拟定位设备(CT Siemens Somato,Siemens Healthcare,德国)采集。本研究通过复旦大学附属中山医院伦理委员会批准(B2021-546),所有患者均知情且签署知情同意书。
1.2 器官的自动及人工勾画采用AccuContour系统[3]对胃和十二指肠进行自动勾画。AccuContour系统为由Manteia公司(厦门)开发的将卷积神经网络与其他传统机器学习技术及图像配准相结合的自动勾画软件。该系统可通过CT图像对多种OAR和靶区进行自动勾画。在自动勾画轮廓基础上,分别外扩1、3、5、8、10 mm。自动勾画完成后,由经验丰富的剂量师参照RTOG指南[11]重新勾画,并由主管医生审核确认。
1.3 器官的几何评估参数和DEP获取采用戴斯相似系数(Dice similarity coefficient, DSC)和95%豪斯多夫距离(95% Hausdorf distance, HD95)[12]评估勾画结果。DEP包括最高剂量(Dmax)、均剂量(Dmean)以及剂量体积直方图(dose volume histogram,DVH)上剂量≥30 Gy对应的体积(V30)[13-15],均以临床治疗计划中的剂量分布为依据。将上述自动勾画的OAR(包括外扩结构)对应的DEP减去人工勾画对应的DEP,得到各DEP的差异值(difference of DEP, D-DEP)。
1.4 统计学处理采用SPSS 22.0软件进行统计分析。采用Shapiro-Wilk检验对几何评估参数和DEP进行正态分布检验。符合正态分布的计量资料以x±s表示,不符合者以M(P25, P75)表示。采用Mann-Whitney U检验比较胃和十二指肠的DSC和HD95;采用Wilcoxon秩和检验比较相邻外扩距离导致的D-DEP。若差异有统计学意义,计算采用不同外扩距离时自动与人工勾画的各样本D-DEP的均值,采用bootstrap法评估数据95%CI。将95%CI下限值与外扩距离进行线性拟合,计算使D-DEP≥0所需要的最小外扩距离。采样数设置为1 000。检验水准(α)为0.05。
2 结果 2.1 胃和十二指肠自动勾画结果结果(图 1)显示:胃的DSC和HD95分别为0.944(0.924, 0.968)和4.736(2.000, 9.858);十二指肠的DSC和HD95分别为0.804(0.710, 0.874)和10.908(4.970, 21.493)。胃的自动勾画结果优于十二指肠(P<0.001)。
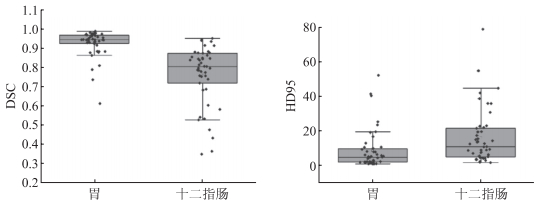
|
| 图 1 胃和十二指肠的自动勾画结果 |
结果(图 2)显示:胃的各D-DEP总体小于十二指肠。胃和十二指肠D-Dmax随着外扩距离的变大而变大,相邻外扩距离间差异均有统计学意义(P<0.001)。胃外扩0与1 mm、3与5 mm,十二指肠外扩0与1 mm、1与3 mm时的D-Dmean差异有统计学意义(P<0.05)。胃外扩0、1、3、5 mm相邻距离间,十二指肠外扩0与1 mm时的D-V30差异有统计学意义(P<0.05)。
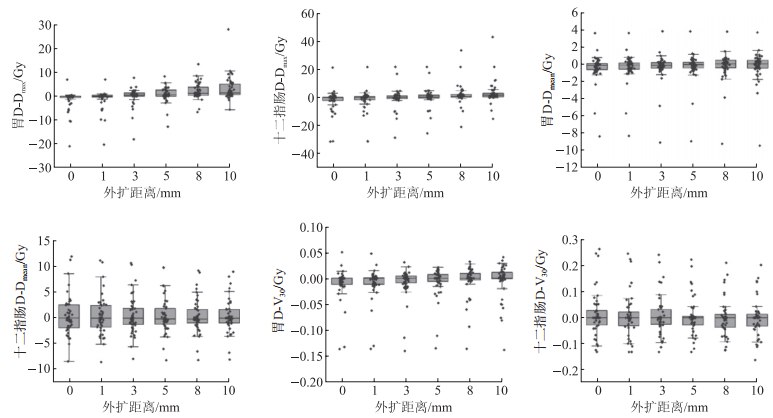
|
| 图 2 外扩自动勾画对各D-DEP的影响 |
线性拟合结果(图 3、表 1)显示:在胃勾画较差[DSC:0.870(0.793, 0.883)]与较好[DSC:0.957(0.943, 0.971)]的样本,以及十二指肠勾画较差[DSC:0.592(0.487, 0.733)]与较好[DSC:0.847(0.805, 0.890)]的样本间,十二指肠勾画较差的样本外扩距离更大。DSC>0.8时,将自动勾画的OAR外扩约7 mm,该结构引起的Dmax 95%大于或等于人工勾画引起的Dmax;将自动勾画的OAR外扩5 mm,即使Dmax低于人工勾画OAR,其差异也不会超过1 Gy。
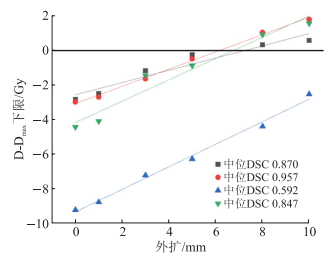
|
| 图 3 D-Dmax均值的95%CI下限值随外扩距离的变化 |
| 中位 DSC |
a | b | R2 | 外扩距离 /mm |
外扩5 mm时 D-Dmax/Gy |
| 0.870 | 0.35 | -2.57 | 0.93 | 7.26 | -0.80 |
| 0.957 | 0.50 | -3.07 | 1.00 | 6.18 | -0.58 |
| 0.592 | 0.65 | -9.33 | 0.99 | 14.32 | -6.07 |
| 0.847 | 0.62 | -4.17 | 0.96 | 6.76 | -1.09 |
| a:斜率;b:直线与y轴的截距;R2:直线拟合的决定系数。 | |||||
基于深度学习的自动勾画在临床上的应用越来越多,不同器官的勾画质量不同,相比于肝、肾、肺等并行器官,脊髓、直肠等串行器官的勾画精度相对较差[5]。而且,自动勾画模型的训练集常来自正常的CT图像,而实际应用时需要勾画的OAR常伴肿瘤侵袭、手术后器官缺失等,导致勾画偏差[16]。串行器官的DEP主要为Dmax,因此保证自动勾画OAR的Dmax大于或等于人工勾画OAR具有重要的临床意义。本研究提供了一种简单的方法,即将自动勾画进行外扩。
多项研究[17-19]证明,OAR的自动勾画和其导致的与人工勾画剂量差异之间相关性弱。本研究显示,几何评估参数影响外扩所引起的剂量改变,提示提高OAR的勾画精度具有重要意义。本研究中,胃的各D-DEP总体小于十二指肠,这与胃的自动勾画结果更好一致。将自动勾画的OAR外扩一定距离可以降低其与人工勾画OAR的Dmax差异,该外扩距离受到勾画准确性的影响。在DSC大于0.8时,外扩约7 mm时,可以较好保证自动勾画所引起的Dmax大于或等于人工勾画;外扩5 mm时,可以保证外扩所引起的Dmax即使低于人工勾画,其差异也不会超过1 Gy。此外,采用自动勾画的器官进行计划设计时,剂量分布除受自动勾画结果的影响外,还受计划设计系统(treatment planning system,TPS)的影响。因此,本研究依据人工勾画器官产生的剂量分布进行分析。但在临床路径中,物理师须依据自动勾画的结果来进行剂量的优化和计算。因此,本研究结果应用于临床时,有2种路径:(1)将自动勾画的结果外扩一定距离,再计划设计;(2)将自动勾画的OAR直接用于设计计划,评估剂量时,外扩一定距离。其中,前者可能提升计划设计的难度,而2种方式对D-DEP的影响有待进一步分析。
综上所述,本研究显示,外扩自动勾画OAR对各自动勾画与人工勾画D-DEP有重要影响,将自动勾画的OAR外扩一定距离可降低其与人工勾画OAR的Dmax差异。但是,本研究中外扩值来源于单中心数据,而且仅针对胃和十二指肠进行了研究,应用于其他中心或其他器官时,可能须重新计算。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
ELDESOKY A R, YATES E S, NYENG T B, et al. Internal and external validation of an ESTRO delineation guideline-dependent automated segmentation tool for loco-regional radiation therapy of early breast cancer[J]. Radiother Oncol, 2016, 121(3): 424-430.
[DOI]
|
| [2] |
WALKER G V, AWAN M, TAO R D, et al. Prospective randomized double-blind study of atlas-based organ-at-risk autosegmentation-assisted radiation planning in head and neck cancer[J]. Radiother Oncol, 2014, 112(3): 321-325.
[DOI]
|
| [3] |
霍新颖, 王敏, 时飞跃, 等. AccuContour和DeepViewer两款软件自动勾画胰腺癌患者肾脏结构的比较[J]. 中国医疗设备, 2021, 36(7): 52-54. HUO X Y, WANG M, SHI F Y, et al. Comparison of AccuContour and DeepViewer in automatic contouring of renal structure for pancreatic cancer patients[J]. China Med Devices, 2021, 36(7): 52-54. [DOI] |
| [4] |
陈子印, 白艳春, 徐巍, 等. 人工智能云技术在乳腺癌患者心脏亚结构自动勾画中的应用[J]. 中国医学物理学杂志, 2020, 37(12): 1599-1603. CHEN Z Y, BAI Y C, XU W, et al. Application of artificial intelligence cloud technology in auto-segmentation of cardiac substructure of breast cancer patients[J]. Chin J Med Phys, 2020, 37(12): 1599-1603. [DOI] |
| [5] |
SAHINER B, PEZESHK A, HADJIISKI L M, et al. Deep learning in medical imaging and radiation therapy[J]. Med Phys, 2019, 46(1): e1-e36.
[DOI]
|
| [6] |
SAARNAK A E, BOERSMA M, VAN BUNNINGEN B N, et al. Inter-observer variation in delineation of bladder and rectum contours for brachytherapy of cervical cancer[J]. Radiother Oncol, 2000, 56(1): 37-42.
[DOI]
|
| [7] |
MARKS L B, YORKE E D, JACKSON A, et al. Use of normal tissue complication probability models in the clinic[J]. Int J Radiat Oncol Biol Phys, 2010, 76(3 Suppl): S10-S19.
|
| [8] |
HANNA G G, MURRAY L, PATEL R, et al. UK consensus on normal tissue dose constraints for stereotactic radiotherapy[J]. Clin Oncol (R Coll Radiol), 2018, 30(1): 5-14.
[DOI]
|
| [9] |
BRODIN N P, KABARRITI R, GARG M K, et al. Systematic review of normal tissue complication models relevant to standard fractionation radiation therapy of the head and neck region published after the QUANTEC reports[J]. Int J Radiat Oncol Biol Phys, 2018, 100(2): 391-407.
[DOI]
|
| [10] |
GERHARD S G, PALMA D A, ARIFIN A J, et al. Organ at risk dose constraints in SABR: a systematic review of active clinical trials[J]. Pract Radiat Oncol, 2021, 11(4): e355-e365.
[DOI]
|
| [11] |
JABBOUR S K, HASHEM S A, BOSCH W, et al. Upper abdominal normal organ contouring guidelines and atlas: a Radiation Therapy Oncology Group consensus[J]. Pract Radiat Oncol, 2014, 4(2): 82-89.
[DOI]
|
| [12] |
TAHA A A, HANBURY A. Metrics for evaluating 3D medical image segmentation: analysis, selection, and tool[J]. BMC Med Imaging, 2015, 15: 29.
[DOI]
|
| [13] |
HUANG J Y, ROBERTSON J M, YE H, et al. Dose-volume analysis of predictors for gastrointestinal toxicity after concurrent full-dose gemcitabine and radiotherapy for locally advanced pancreatic adenocarcinoma[J]. Int J Radiat Oncol Biol Phys, 2012, 83(4): 1120-1125.
[DOI]
|
| [14] |
KIM H, LIM D H, PAIK S W, et al. Predictive factors of gastroduodenal toxicity in cirrhotic patients after three-dimensional conformal radiotherapy for hepatocellular carcinoma[J]. Radiother Oncol, 2009, 93(2): 302-306.
[DOI]
|
| [15] |
BAE S H, KIM M S, CHO C K, et al. Predictor of severe gastroduodenal toxicity after stereotactic body radiotherapy for abdominopelvic malignancies[J]. Int J Radiat Oncol Biol Phys, 2012, 84(4): e469-e474.
[DOI]
|
| [16] |
PREVEDELLO L M, HALABI S S, SHIH G, et al. Challenges related to artificial intelligence research in medical imaging and the importance of image analysis competitions[J]. Radiol Artif Intell, 2019, 1(1): e180031.
[DOI]
|
| [17] |
余行, 刘欢, 傅玉川. 放疗影像自动分割效果评估中几何参数与剂量学参数之间的关联性[J]. 中国医学物理学杂志, 2021, 38(5): 540-544. YU H, LIU H, FU Y C. Correlation between geometric parameters and dosimetric parameters in the evaluation of image auto-segmentation for radiotherapy[J]. Chin J Med Phys, 2021, 38(5): 540-544. [DOI] |
| [18] |
VOET P W, DIRKX M L, TEGUH D N, et al. Does atlas-based autosegmentation of neck levels require subsequent manual contour editing to avoid risk of severe target underdosage? A dosimetric analysis[J]. Radiother Oncol, 2011, 98(3): 373-377.
[DOI]
|
| [19] |
KIESELMANN J P, KAMERLING C P, BURGOS N, et al. Geometric and dosimetric evaluations of atlas-based segmentation methods of MR images in the head and neck region[J]. Phys Med Biol, 2018, 63(14): 145007.
[DOI]
|
 2022, Vol. 29
2022, Vol. 29


