慢性乙型肝炎病毒(HBV)感染是全球性公共卫生事件,若不采取措施,可发展为肝硬化、肝癌等严重肝病[1]。慢性乙型肝炎若不进行有效抗病毒治疗,进展为肝硬化的概率为2%~10%[2];肝硬化从代偿期发展为失代偿期的发生率为3%~5%,而失代偿期肝硬化患者5年总生存率(OS)不足35%[2]。在治疗肝硬化原发病的基础上,早期识别并预防并发症的发生是提高肝硬化治疗效果的重要途径[3]。
评估肝硬化患者肝功能状况的传统指标主要有Child-Pugh评分、终末期肝病模型(MELD)评分及吲哚菁绿清除试验(ICGR15)等[4-5]。近期研究[6-9]发现,中性粒细胞计数/淋巴细胞计数(NLR)、凝血酶原国际标准化比值/白蛋白(PTAR)等指标对肝纤维化及肝硬化严重程度有重要的评估价值。目前有关这些新型指标与传统指标联合评估失代偿期乙肝肝硬化患者预后的研究较少,本研究对此进行探讨,以期提高临床对失代偿期乙肝肝硬化患者短期预后的评估水平,进而指导治疗。
1 资料与方法 1.1 研究对象回顾性分析2018年1月至2021年6月南通大学附属南通第三医院收治的153例失代偿期乙肝肝硬化患者的临床资料。根据计算机随机分配原则将患者分为建模组与验证组,其中建模组113例、验证组40例。纳入标准:(1)符合失代偿期肝硬化诊断标准;(2)有乙型肝炎病史,就诊时HBsAg和(或)HBV DNA阳性;(3)有完整的治疗前血液学检查结果。排除标准:(1)合并肝癌或其他部位恶性肿瘤;(2)合并造血、免疫系统疾病或心脑肺功能障碍;(3)肝衰竭患者;(4)合并丙型肝炎病毒感染或其他原因引起的肝硬化;(5)已行肝移植手术;(6)随访资料缺失。本研究通过医院伦理委员会审批(EL2022018),患者知情同意并签署知情同意书。
1.2 观察指标收集患者年龄、性别、短期预后情况及治疗前首次实验室血液学指标。血液学指标主要包括白细胞计数(WBC)、中性粒细胞计数、淋巴细胞计数、血红蛋白(Hb)、血小板计数(PLT)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶、谷氨酰转肽酶(GGT)、碱性磷酸酶(ALP)、总胆红素(TBil)、白蛋白(Alb)、肌酐(Cr)、凝血酶原国际标准化比值(INR)。NLR=中性粒细胞计数/淋巴细胞计数;PTAR=INR/Alb;MELD评分=3.78×lnTBil+9.57×lnCr+11.2×lnINR+6.43×病因,其中病因为胆汁性或酒精性时赋值为0,其他赋值为1[10]。
1.3 治疗方法患者入院后均接受恩替卡韦或富马酸替诺福韦酯等核苷(酸)类药物抗病毒治疗,并接受甘草酸制剂、谷胱甘肽等抗炎保肝治疗,配合Alb等免疫调节治疗及退黄、利尿等对症治疗。
1.4 疗效评估及随访疾病好转:(1)精神、食欲、乏力等症状明显改善;(2)皮肤黄染、腹水、全身浮肿等体征明显改善;(3)肝肾功能、凝血功能明显改善;(4)肝性脑病、上消化道出血等并发症症状消失或明显缓解。疾病进展:(1)以上症状、体征持续不缓解或加重;(2)实验室血液学相关指标水平升高;(3)出现新的并发症;(4)非其他原因导致患者死亡。患者疾病好转与进展均由2位副高级或以上职称肝病科医师共同认定。
以治疗开始当天为观察起点,治疗开始后6个月末为观察终点,通过电话随访或门诊了解患者生存状态。根据观察终点生存状态,将患者分为好转组和进展组。随访时间截至2021年12月31日。
1.5 统计学处理采用SPSS 26.0软件进行统计学分析。正态分布的计量资料以x±s表示,组间比较采用t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验。计数资料以n表示,组间比较采用χ2检验。非正态分布的连续性变量的相关性采用Spearman等级相关性分析;单因素及多因素分析采用二元logistic回归模型。采用二元logistic回归,enter法纳入变量,构建联合预测模型,计算受试者工作特征曲线下面积(AUC),比较各模型的预测效能。采用Hosmer-Lemeshow拟合优度检验评估联合预测模型的校准度;将验证组数据代入构建的联合预测模型,绘制ROC曲线,进行效能验证。检验水准(α)为0.05。
2 结果 2.1 建模组基线特征建模组113例患者中,疾病好转52例,疾病进展61例。好转患者中男性37例、女性15例,年龄32~72岁,平均(52.37±7.70)岁;进展患者中男性44例、女性17例,年龄35~74岁,平均(54.87±7.69)岁。结果(表 1)显示:两亚组患者Hb、PLT、ALT、AST、ALP、TBil、Alb、NLR、PTAR及MELD评分差异均有统计学意义(P<0.05)。
| 项目 | 好转组(n=52) | 进展组(n=61) | t/χ2/z值 | P值 |
| 年龄/岁 | 52.37±7.70 | 54.87±7.69 | -1.723 | 0.088 |
| 男/女n | 37/15 | 44/17 | 0.013 | 0.909 |
| WBC/(×109·L-1) | 4.37 (2.77, 7.61) | 6.21 (3.48, 7.83) | -1.818 | 0.069 |
| Hb/(g·L-1) | 111.83±23.45 | 102.43±23.51 | 2.121 | 0.036 |
| PLT/(×109·L-1) | 122.50 (74.25, 155.50) | 75.00 (33.50, 122.50) | -2.739 | 0.006 |
| ALT/(U·L-1) | 39.50 (19.50, 72.75) | 60.00 (32.00, 126.50) | -2.662 | 0.008 |
| AST/(U·L-1) | 58.50 (32.25, 76.00) | 96.00 (53.00, 242.50) | -4.116 | <0.001 |
| GGT/(U·L-1) | 74.50 (31.25, 132.00) | 91.00 (37.50, 184.50) | -1.671 | 0.095 |
| ALP/(U·L-1) | 110.00 (83.25, 153.75) | 157.00 (96.50, 230.00) | -2.555 | 0.011 |
| TBil/(μmol·L-1) | 68.10 (33.53, 134.80) | 134.70 (58.20, 313.35) | -3.557 | <0.001 |
| Alb/(g·L-1) | 30.81±3.74 | 27.64±2.48 | 5.230 | <0.001 |
| Cr/(μmol·L-1) | 68.50 (52.25, 78.50) | 74.00 (55.50, 87.00) | -1.391 | 0.164 |
| NLR | 2.28 (1.41, 4.22) | 5.25 (2.78, 9.49) | -4.355 | <0.001 |
| PTAR | 35.52 (26.75, 51.86) | 67.69 (50.93, 95.44) | -5.403 | <0.001 |
| MELD/分 | 9.33 (7.88, 13.78) | 16.32 (10.80, 20.18) | -4.548 | <0.001 |
| WBC:白细胞计数;Hb:血红蛋白;PLT:血小板计数;ALT:丙氨酸氨基转移酶;AST:天冬氨酸氨基转移酶;GGT:谷氨酰转肽酶;ALP:碱性磷酸酶;TBil:总胆红素;Alb:白蛋白;Cr:肌酐;INR:凝血酶原国际标准化比值;NLR:中性粒细胞计数/淋巴细胞计数;PTAR:凝血酶原国际标准化比值/白蛋白;MELD:终末期肝病模型。 | ||||
Spearman等级相关性分析(图 1)显示:建模组NLR、PTAR与MELD评分正相关(r值分别为0.444、0.438,P<0.001),NLR与PTAR正相关(r=0.435,P<0.001)。

|
| 图 1 NLR、PTAR及MELD评分的相关性分析 |
Logistic单因素分析结果(表 2)显示:Hb、PLT、ALT、AST、ALP、TBil、Alb、NLR、PTAR、MELD评分影响建模组患者短期预后(P<0.05)。Logistic多因素分析(表 3)显示:AST、Alb、NLR、PTAR、MELD评分为建模组患者短期预后的独立影响因素(P<0.05)。
| 变量 | B值 | 标准误 | Wald值 | P值 | OR | 95%CI |
| 年龄 | 0.043 | 0.026 | 2.847 | 0.092 | 1.044 | 0.993~1.098 |
| 性别 | -0.048 | 0.419 | 0.013 | 0.909 | 0.953 | 0.420~2.165 |
| WBC | 0.126 | 0.072 | 3.032 | 0.082 | 1.134 | 0.984~1.306 |
| Hb | -0.017 | 0.008 | 4.225 | 0.040 | 0.983 | 0.967~0.999 |
| PLT | -0.009 | 0.003 | 6.576 | 0.010 | 0.992 | 0.985~0.998 |
| ALT | 0.005 | 0.003 | 3.876 | 0.049 | 1.005 | 1.000~1.010 |
| AST | 0.010 | 0.003 | 11.975 | 0.001 | 1.010 | 1.004~1.016 |
| GGT | 0.003 | 0.002 | 2.069 | 0.150 | 1.003 | 0.999~1.007 |
| ALP | 0.007 | 0.003 | 7.101 | 0.008 | 1.007 | 1.002~1.013 |
| TBil | 0.007 | 0.002 | 12.165 | <0.001 | 1.007 | 1.003~1.011 |
| Alb | -0.318 | 0.072 | 19.498 | <0.001 | 0.728 | 0.632~0.838 |
| Cr | 0.009 | 0.007 | 1.588 | 0.208 | 1.009 | 0.995~1.023 |
| NLR | 0.276 | 0.070 | 15.407 | <0.001 | 1.317 | 1.148~1.512 |
| PTAR | 0.036 | 0.008 | 18.548 | <0.001 | 1.036 | 1.020~1.053 |
| MELD | 0.163 | 0.041 | 16.186 | <0.001 | 1.177 | 1.087~1.274 |
| WBC:白细胞计数;Hb:血红蛋白;PLT:血小板计数;ALT:丙氨酸氨基转移酶;AST:天冬氨酸氨基转移酶;GGT:谷氨酰转肽酶;ALP:碱性磷酸酶;TBil:总胆红素;Alb:白蛋白;Cr:肌酐;NLR:中性粒细胞计数/淋巴细胞计数;PTAR:凝血酶原国际标准化比值/白蛋白;MELD:终末期肝病模型。 | ||||||
| 变量 | B值 | 标准误 | Wald值 | P值 | OR | 95%CI |
| Hb | 0.011 | 0.013 | 0.721 | 0.396 | 1.011 | 0.986~1.037 |
| PLT | 0.009 | 0.007 | 1.982 | 0.159 | 1.009 | 0.996~1.023 |
| ALT | ﹣0.001 | 0.005 | 0.021 | 0.885 | 0.999 | 0.990~1.009 |
| AST | 0.009 | 0.004 | 4.806 | 0.028 | 1.009 | 1.001~1.017 |
| ALP | ﹣0.005 | 0.005 | 1.344 | 0.246 | 0.995 | 0.986~1.004 |
| TBil | 0.006 | 0.003 | 3.734 | 0.053 | 1.006 | 1.000~1.012 |
| Alb | ﹣0.343 | 0.102 | 11.247 | 0.001 | 0.710 | 0.581~0.867 |
| NLR | 0.253 | 0.103 | 6.022 | 0.014 | 1.287 | 1.052~1.575 |
| PTAR | 0.026 | 0.012 | 4.651 | 0.031 | 1.026 | 1.002~1.051 |
| MELD | 0.143 | 0.060 | 5.667 | 0.017 | 1.154 | 1.026~1.299 |
| Hb:血红蛋白;PLT:血小板计数;ALT:丙氨酸氨基转移酶;AST:天冬氨酸氨基转移酶;ALP:碱性磷酸酶;TBil:总胆红素;Alb:白蛋白;NLR:中性粒细胞计数/淋巴细胞计数;PTAR:凝血酶原国际标准化比值/白蛋白;MELD:终末期肝病模型。 | ||||||
ROC曲线结果(图 2、表 4)显示:NLR、PTAR、MELD评分最佳截断值分别为5.045、49.405、15.295,预测患者疾病进展的AUC分别为0.738、0.796、0.749(P<0.001),灵敏度分别为0.541、0.820、0.607,特异度分别为0.846、0.712、0.865。采用二元logistic回归构建联合预测概率模型,分别为logit(P)=-2.454+0.205×NLR+0.029×PTAR;logit(P)=-2.559+0.207×NLR+0.131×MELD;logit(P)=-3.149+0.028×PTAR+0.122×MELD;logit(P)=-3.416+0.166×NLR+0.024×PTAR+0.104×MELD。其中,三者联合预测模型的预测效能最佳,最佳截断值为0.478,AUC为0.832(P<0.001),灵敏度为0.852,特异度为0.750。

|
| 图 2 失代偿期乙肝肝硬化患者预测疾病进展的ROC曲线 |
| 指标 | AUC | 95%CI | 截断值 | 灵敏度 | 特异度 | 约登指数 | P值 |
| NLR | 0.738 | 0.648~0.829 | 5.045 | 0.541 | 0.846 | 0.387 | <0.001 |
| PTAR | 0.796 | 0.711~0.881 | 49.405 | 0.820 | 0.712 | 0.532 | <0.001 |
| MELD | 0.749 | 0.658~0.840 | 15.295 | 0.607 | 0.865 | 0.472 | <0.001 |
| NLR+PTAR | 0.811 | 0.731~0.891 | 0.333 | 0.951 | 0.596 | 0.547 | <0.001 |
| NLR+MELD | 0.793 | 0.707~0.878 | 0.477 | 0.803 | 0.769 | 0.572 | <0.001 |
| PTAR+MELD | 0.819 | 0.739~0.900 | 0.454 | 0.820 | 0.712 | 0.532 | <0.001 |
| NLR+PTAR+MELD | 0.832 | 0.755~0.909 | 0.478 | 0.852 | 0.750 | 0.602 | <0.001 |
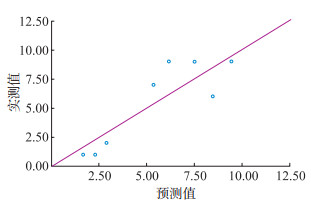
Hosmer-Lemeshow拟合优度检验(图 3)显示:联合预测模型的校准度较好(χ2=10.16,P=0.254)。
|
| 图 3 联合预测模型的校准曲线 |
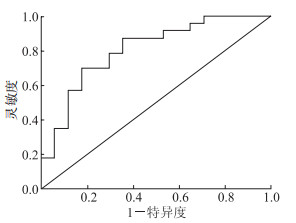
将验证组40例患者治疗前的NLR、PTAR、MELD评分代入联合预测模型,ROC曲线(图 4)显示:联合预测模型预测验证组患者治疗6个月后疾病进展的AUC为0.803(95%CI 0.663~0.943,P=0.001)。
|
| 图 4 联合预测模型在验证组预测疾病进展的ROC曲线 |
慢性HBV感染在我国较常见,早期无明显症状,患者常在就诊时已发展为肝硬化,甚至已处于失代偿期肝硬化状态。此时患者常合并多种并发症,如腹水、脾亢、肝肾综合征、上消化道出血、肝性脑病等,预后较差[11]。早期有效预测对于改善失代偿期乙肝肝硬化患者预后、降低死亡率具有重要价值[12]。
中性粒细胞是机体发生炎症的血液学表现,而淋巴细胞反映机体的免疫功能。因此,近年来,多项研究认为NLR可以作为肝硬化患者预后的评价指标[13]。NLR可反映肝脏受损情况,其水平与肝硬化、肝纤维化、脂肪肝的严重程度密切相关[14]。Li等[15]回顾性分析了174例代偿期肝硬化患者的血液学检查资料,发现死亡患者的NLR明显高于存活患者,且NLR是代偿期肝硬化患者死亡的独立预测因素。Shi等[16]在接受恩替卡韦或替诺福韦治疗的1 599例乙肝肝硬化患者中发现,NLR升高是接受抗病毒治疗的乙肝肝硬化患者发生肝细胞癌的独立危险因素。
PTAR是INR与Alb比值,与其他肝功能指标相比,其不受胆红素水平干扰。2018年日本学者Haruki首次提出这一概念。Haruki等[17]纳入199例行肝切除手术的肝癌患者,发现高PTAR患者病理性肝硬化、术后腹水及术后肝功能衰竭的发生率明显高于低PTAR患者,认为PTAR水平可以反映肝功能状态,可作为肝切除术后肝癌患者预后不良的新指标。一项纳入865例重症肝硬化患者的研究[18]发现,PTAR水平与患者确诊后90 d死亡风险相关,风险比达2.71,显示出PTAR对重症肝硬化患者良好的预测能力。Cai等[8]也认为,高PTAR水平与乙肝相关失代偿期肝硬化患者的不良预后相关,PTAR水平与疾病严重程度正相关,可作为判断该类患者预后的预测因子。
MELD评分作为一种评估各种肝病患者预后的传统指标在临床广泛使用,越高提示患者预后越差。MELD评分相对腹水、并发症等主观性比较强的指标更为客观,但有学者研究[19]认为MELD评分用于失代偿期乙肝肝硬化患者预后判断的稳定性不高,主要原因在于该评分系统中未纳入炎症反应及免疫状态相关指标,而失代偿期乙肝肝硬化患者常伴有免疫功能障碍及慢性炎症反应。
不同类型指标联合检测用于评估肝病预后具有灵敏度、特异度高的优势。陈卉等[13]评估了408例肝硬化患者治疗3个月后的预后情况,结果表明NLR和MELD预测死亡的AUC分别为0.739和0.746,而NLR与MELD联合检测的AUC为0.847,明显高于单项指标。康宁等[20]纳入195例乙肝肝硬化患者,发现PTAR、ICGR15预测患者慢加急性肝衰竭发生的AUC为0.776、0.799,而联合检测的AUC为0.860。康宁等[21]进一步将PTAR和MELD评分进行联合检测用于评估酒精性肝硬化患者的预后,结果也表明单一指标对慢性及急性肝衰竭发生的预测能力弱于联合模型,联合模型预测最佳截断值为-2.15,如果数值大于-2.15,则慢性及急性肝衰竭的发生率升高。
本研究中,建模组进展患者NLR、PTAR及MELD评分均高于好转患者,差异有统计学意义(P<0.05)。Spearman相关性分析显示,NLR、PTAR与MELD评分呈正相关(r值分别为0.444、0.438,P<0.001),NLR与PTAR正相关(r=0.435,P<0.001)。Logistic多因素分析结果显示,AST、Alb、NLR、PTAR、MELD评分是影响失代偿期乙肝肝硬化患者短期预后的独立因素(P<0.05)。其中,NLR、PTAR、MELD评分预测疾病进展的AUC分别为0.738、0.796、0.749,三者联合时,AUC提高到0.832,且模型校准度、稳定性较好。
综上所述,本研究表明,NLR、PTAR、MELD评分可作为失代偿期乙肝肝硬化患者短期预后的独立预测因子,具有较好的预测价值,三者联合预测的价值更高。NLR、PTAR、MELD评分在临床上较易获取,用于评估失代偿期乙肝肝硬化患者短期预后时简便易行,值得进一步推广。但本研究样本量偏小,因此结论有待多中心研究验证。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
LI H, YAN L B, SHI Y, et al. Hepatitis B virus infection: overview[J]. Adv Exp Med Biol, 2020, 1179: 1-16.
|
| [2] |
FATTOVICH G, BORTOLOTTI F, DONATO F. Natural history of chronic hepatitis B: special emphasis on disease progression and prognostic factors[J]. J Hepatol, 2008, 48(2): 335-352.
[DOI]
|
| [3] |
唐琴林, 祝峻峰, 王灵台, 等. 新清开方联合醒脑鼻嗅剂防治乙肝后肝硬化合并轻微型肝性脑病的临床研究[J]. 同济大学学报(医学版), 2022, 43(2): 209-215. TANG Q L, ZHU J F, WANG L T, et al. Efficacy of Chinese medicine Xinqingkai prescription combined with Xingnao nasal olfactory agent for patients with posthepatitic cirrhosis and minimal hepatic encephalopathy[J]. J Tongji Uni (Med Sci), 2022, 43(2): 209-215. [CNKI] |
| [4] |
KIM T H, YUN S G, CHOI J, et al. Differential impact of serum 25-hydroxyvitamin D3 levels on the prognosis of patients with liver cirrhosis according to MELD and child-pugh scores[J]. J Korean Med Sci, 2020, 35(19): e129.
[DOI]
|
| [5] |
秦榕, 陈思瑾, 黄芸, 等. 感染对肝硬化食管胃底静脉曲张破裂出血患者预后的影响[J]. 临床内科杂志, 2021, 38(5): 317-320. QIN R, CHEN S J, HUANG Y, et al. Influence of infection on the prognosis of esophagogastric varices bleeding patients with liver cirrhosis[J]. J Clinl Int Med, 2021, 38(5): 317-320. [DOI] |
| [6] |
PENG Y, LI Y, HE Y H, et al. The role of neutrophil to lymphocyte ratio for the assessment of liver fibrosis and cirrhosis: a systematic review[J]. Expert Rev Gastroenterol Hepatol, 2018, 12(5): 503-513.
[DOI]
|
| [7] |
CHANG M L, CHENG J S, CHIEN R N, et al. Hepatitis flares are associated with better outcomes than No flare in patients with decompensated cirrhosis and chronic hepatitis B virus infection[J]. Clin Gastroenterol Hepatol, 2020, 18(9): 2064-2072.e2.
[DOI]
|
| [8] |
CAI M, HAN Z, HE X, et al. Usefulness of international normalized ratio to albumin ratio for evaluation of mortality in hepatitis B virus-associated decompensated cirrhosis[J]. Biomed Res Int, 2021, 2021: 6664574.
|
| [9] |
LI Q, LÜ Z Z, WANG L G, et al. Albumin-to-alkaline phosphatase ratio associates with good prognosis of hepatitis B virus-positive HCC patients[J]. Onco Targets Ther, 2020, 13: 2377-2384.
[DOI]
|
| [10] |
KAMATH P S, WIESNER R H, MALINCHOC M, et al. A model to predict survival in patients with end-stage liver disease[J]. Hepatology, 2001, 33(2): 464-470.
[DOI]
|
| [11] |
冯志刚, 李涛, 赵冰清, 等. 复方鳖甲软肝片联合恩替卡韦对乙肝肝硬化失代偿期患者疗效、肝功能、免疫功能影响研究[J]. 中华中医药学刊, 2022, 40(1): 184-187. FENG Z G, LI T, ZHAO B Q, et al. Effect of compound Biejia Ruanjian Tablet(复方鳖甲软肝片) combined with entecavir on efficacy, liver function and immune function of patients with hepatitis B cirrhosis at decompensated stage[J]. Chinese Archives of Traditional Chinese Medicine, 2022, 40(1): 184-187. [CNKI] |
| [12] |
NIE Y, LIU L X, CHEN T, et al. Serum lactate level predicts 6-months mortality in patients with hepatitis B virus-related decompensated cirrhosis: a retrospective study[J]. Epidemiol Infect, 2021, 149: e26.
[DOI]
|
| [13] |
陈卉, 谭诗云. MELD评分联合NLR预测肝硬化患者短期预后的价值[J]. 医学研究杂志, 2019, 48(5): 143-147. CHEN H, TAN S Y. Value of MELD score combined with NLR in predicting the short-term prognosis of patients with liver cirrhosis[J]. Journal of Medical Research, 2019, 48(5): 143-147. [CNKI] |
| [14] |
HORVATITS T, DROLZ A, ROEDL K, et al. Serum bile acids as marker for acute decompensation and acute-on-chronic liver failure in patients with non-cholestatic cirrhosis[J]. Liver Int, 2017, 37(2): 224-231.
[DOI]
|
| [15] |
LI X K, WU J P, MAO W L. Evaluation of the neutrophil-to-lymphocyte ratio, monocyte-to-lymphocyte ratio, and red cell distribution width for the prediction of prognosis of patients with hepatitis B virus-related decompensated cirrhosis[J]. J Clin Lab Anal, 2020, 34(11): e23478.
|
| [16] |
SHI K, LI P, XUE D Y, et al. Neutrophil-lymphocyte ratio and the risk of hepatocellular carcinoma in patients with hepatitis B-caused cirrhosis[J]. Eur J Gastroenterol Hepatol, 2021, 33(1S Suppl 1): e686-e692.
|
| [17] |
HARUKI K, SHIBA H, SAITO N, et al. Risk stratification using a novel liver functional reserve score of combination prothrombin time-international normalized ratio to albumin ratio and albumin in patients with hepatocellular carcinoma[J]. Surgery, 2018, 164(3): 404-410.
[DOI]
|
| [18] |
GAO F, CAI M X, LIN M T, et al. Prognostic value of international normalized ratio to albumin ratio among critically ill patients with cirrhosis[J]. Eur J Gastroenterol Hepatol, 2019, 31(7): 824-831.
[DOI]
|
| [19] |
崔大广, 肖玲燕, 刘永福, 等. CTP-MELD评分联合血清M30和M65预测乙型肝炎相关慢加急性肝衰竭短期预后的价值[J]. 肝脏, 2022, 27(1): 58-62. CUI D G, XIAO L Y, LIU Y F, et al. The predictive value of CTP-MELD scores combined with serum M30 and M65 levels for the short-term prognosis of patients with hepatitis B-related acute-on-chronic liver failure[J]. Chinese Hepatology, 2022, 27(1): 58-62. [CNKI] |
| [20] |
康宁, 王存凯, 齐丽翠, 等. PTAR联合ICGR15对乙肝肝硬化患者发生慢加急性肝衰竭的预测价值研究[J]. 中国实用内科杂志, 2020, 40(7): 558-562. KANG N, WANG C K, QI L C, et al. Clinical significance of PTAR and ICGR15 joint score in predicting the occurrence of acute-on-chronic liver failure in patients with hepatitis B cirrhosis[J]. Chinese Journal of Practical Internal Medicine, 2020, 40(7): 558-562. [CNKI] |
| [21] |
康宁. PTAR、Child-pugh及MELD评分对肝硬化患者发生慢加急性肝衰竭的预测价值研究[D]. 张家口: 河北北方学院, 2020. KANG N. The predicting value of PTAR, child-pugh and MELD score on the occurrence of acute-on-chronic liver failure in the patients with cirrhosis[D]. Zhangjiakou: Hebei North University, 2020. |
 2022, Vol. 29
2022, Vol. 29


