2. 空军军医大学军事预防医学系军队卫生统计学教研室, 西安 710032;
3. 复旦大学附属中山医院生物统计室, 上海 200032;
4. 皖南医学院弋矶山医院, 芜湖 241000;
5. 北京复星医药科技开发有限公司, 北京 100005;
6. 南京医科大学公共卫生学院生物统计学系, 南京 211166;
7. CSCO生物统计学专家委员会RWE项目组
2. Department of Health Statistics, Air Military Medical University, Xi'an 710032, Shaanxi, China;
3. Department of Biostatistics, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
4. The First Affiliated Hospital of Wannan Medical College, Wuhu 241000, Anhui, China;
5. Beijing Technology Ltd, FOSUN Pharmacy, Beijing 100005, China;
6. Department of Biostatistics, School of Public Health, Nanjing Medical University, Nanjing 211166, Jiangsu, China;
7. CSCO Biostatistics Expert Committee RWE Working Group
现实世界研究(real-world study,RWS)是收集现实世界数据(real-world data,RWD)并经分析生成现实世界证据(real-world evidence, RWE)的研究[1]。自1993年Kaplan等[2]首次以发表论文的形式明确提出了RWS的概念以来,RWS应用已涵盖病因、预防、诊断、治疗与预后等多个方面。近年来,通过现实世界的大量临床研究为循证医学提供支持性证据已成为当今临床研究的热门话题。尤其是2016年底,美国国会公布的《21世纪治愈法案》提出,RWS产生的证据可用于药品及医疗器械上市后,研究及新适应证开发的审批,首次将RWE的概念上升到法律层面,引起临床研究领域的极大关注[3]。2019年我国药品审评中心发布《真实世界证据支持药物研发的基本考虑(征求意见稿)》,之后又发布了一系列相关指导原则,从监管层面正式推进我国RWS的证据转化应用。
本研究主要通过检索PubMed、Embase、Web of Science、Scopus、中国生物医学文献服务系统、中国知网、维普网、万方数据库等文献库,收集整理截至2021年7月10日RWS相关的专家共识、指南以及重要观点,对国内外不同领域RWS证据转化的现况进行归纳总结,为现实世界临床研究数据转化为证据的应用提供策略支持。
1 RWS在循证医学证据链中的作用RWS并不局限于病例对照、队列研究、横断面研究等观察性研究,也可以是干预性研究,例如实用临床试验(pragmatic clinical trial, PCT)同样也可以在现实医疗环境下引入随机、分配干预措施,开展贴近临床诊疗实际的随机对照研究。相对于在科学研究环境下开展的随机对照试验(randomized control trial,RCT),RWS具有更好的外推性,可以作为RCT研究的有力补充[4],在循证医学证据链中具有重要作用。通常情况下,小规模或回顾性RWS可为RCT的设计和实施提供参考依据,在RCT获得确证性结果后,可以通过大规模的RWS获得更广泛的支持性证据,提高系列研究整体的证据强度。
RWS的结果用于临床和医疗决策时被称为RWE。RWE是临床有效性和安全性评价证据链的重要组成部分,是在现实医疗环境中通过优化分析多种途径来源的RWD而获得的证据,用来阐述临床证据作用和潜在的利益风险[5]。RWD是产生RWE的基础,没有高质量的适用的RWD支持,RWE亦无从谈起, 但并非所有的RWD经分析后都能产生RWE,只有满足适用性的RWD,经恰当、充分地分析后才有可能形成RWE[6-8]。这一转化过程不仅需要相应的政策法规和指导原则加以规范,更离不开各领域专家达成共识的应用经验。
2 不同领域证据转化应用现状和策略自《21世纪治愈法案》首次将RWE的概念上升到法律层面以来,美国、欧盟各国、加拿大、日本及中国等国内外监管机构相继发布了各类相关政策法规及指导原则,具体内容在汪旻晖等[9]文中已有详细解读,此处不再赘述。可以明确的是,各地区在RWD/RWE应用方面的主体框架基本达成共识,但结合地区政策和现实条件,从概念、数据来源到研究实施等各方面均有不同程度的差异。同样地,即使在现有政策法规和指导原则的框架下RWD转化为RWE的过程能够得到进一步规范,但受不同领域临床研究特殊性所限,若要充分利用RWD进行高效转化,仍需要相关领域在专家共识层面上的专业化指导。为了加快RWS证据转化的全球进程,非常有必要在现有政策法规和指导原则的框架下分析国内外不同领域RWS证据转化的应用现状、归纳总结专家观点共识、探索适用于各领域的证据转化应用策略。
2.1 在药械监管决策方面的应用和策略RWE通常用于支持药品监管决策,包括为新药注册和上市提供有效性和安全性的证据,为上市药品标签的更改提供证据,以及为上市后的要求或重新评估提供证据[10]。美国FDA在RWD和RWE方面的大部分经验来自于医疗器械的监管,使用RWE监测评估药品上市后的安全性已有较长的历史,主要通过传统的药物警戒工具及FDA前哨系统等新型数字辅助工具实现利用RWE监测上市产品的安全性[11]。在欧盟,RWE在药物的整个生命周期中被广泛地接受,包括罕见病的临床研究[12]。中国药品监管科学行动计划正在通过设立RWD支持中药、罕见病治疗药物、创新和临床急需医疗器械评价方法研究等重点项目进一步增强监管工作的科学性、前瞻性和适应性[6, 13]。然而,受各地发展状况约束,RWD转化为RWE在监管决策方面的应用存在一定的障碍。尤其在中国,现有的RWD来源较多,且没有统一的数据传输标准,跨部门数据共享将是未来的挑战和难题,这与欧美国家的高质量RWD、数据共享平台和结构化数据质量标准方面存在明显的差距[14],从而导致应用RWE来支持卫生决策非常有限。
吴宏辉等[15]对欧洲药品管理局(European Medicines Agency,EMA)管理体系进行了系统介绍与分析,就建立符合我国国情的药品上市后有效性研究,从健全法规体系、完善配套管理体系、技术体系的建立与相关指南的制定、方法学研究及中成药相关技术规范等方面提出了具体建议。RWS在加速审评审批过程中可能引入药品有效性和安全性的不确定因素,因此,加强RWD及RWS的风险管理显得尤为重要。2018年中国启动海南博鳌乐城先行区审评审批机制改革。莫成林等[16]在针对先行区RWS支持孤儿药审评审批的质量风险考量中指出,如何配备、落实强大的、贯穿RWS全过程以及上市后监管的风险管控方案以持续评估风险-获益的关系,实现科学监管,仍是当前药监方面最重要的课题之一,同时建议完善我国对罕见病的定义,出台孤儿药清单。随着科技的发展,人工智能技术、云计算等将极大推动RWE的转化进程,新型数据和海外医疗数据的可接受性需要更多指导,医疗数据的隐私保护、数据共享和数据标准化还需要更多的技术和统计支持,监管机构也将面临跨学科的挑战。
面对当前RWD在监管决策方面转化为RWE的应用困境,建议在借鉴欧美等国家应用RWE的监管决策经验的同时,结合当前国情,逐步完善我国RWE支持监管决策体系构建。(1)尽快建立RWD获取的通用数据标准,加强数据共享平台等基础设施建设;(2)引入或开发高效的RWE相关监管科学决策工具;(3)推动学科专家形成各行业的RWD/RWE应用指南;(4)关注卫生决策中考量的研究设计类型的多样化与整合互补;(5)加强RWS各阶段的风险评估和管控。
2.2 在医疗器械临床评价中的应用和策略2017年,在RWE的支持下并通过模拟应用证明了Senhance系统与da Vinci Si IS3000器械在妇科和结直肠手术方面具有等效性,美国FDA批准了该新型机器人辅助手术器械。2020年3月,中国首个使用境内RWD的医疗器械产品—“青光眼引流管”获批上市。同年,我国在发布的《真实世界数据用于医疗器械临床评价技术指导原则(试行)》[17]中明确,RWD可用于医疗器械全生命周期临床评价,包括上市前临床评价及上市后临床评价,但更多的是作为已有临床证据的补充,不能取代现有临床评价路径。医疗器械的疗效评价等因受到伦理或器械技术(如手术)限制,在现实情况中常无法对受试者进行随机分组以及难以实施盲法,RWD的恰当使用可以作为医疗器械临床评价的重要手段[18]。
刘露等[18]就RWE在医疗器械上市前临床评价中的应用建议,RWD应与待评价器械具有良好的相关性,这包括数据应归属于拟评价的器械、应能体现拟评价的适用范围等。同时,不同的器械对于RWE的要求不同,应结合产品的实际特点制定相应的数据收集策略、记录流程和数据统计分析方案。以博鳌乐城创新药械RWD研究模式为例,任燕等[19]指出,在实际医疗环境中开展研究需要整体策划和实施:(1)应首先明确研究的关键要素,至少应包含目标人群和器械、对照、主要结局指标、混杂因素、随访及研究环境等;(2)构建由RWS专家、临床专家、数据团队组成的多学科交叉团队;(3)制定研究方案,在选择研究设计时需要对RWS、乐城医疗环境、监管考虑有充分的理解和深刻的认识;(4)通过伦理审批;(5)基于主动和常规收集的数据源构建登记数据库,形成RWD应用的核心基础。显然,RWD的收集策略是至关重要的,唯有高质量的RWD才有可能转化为高强度的RWE。该模式对于一般RWS同样适用,可借鉴学习(图 1)。
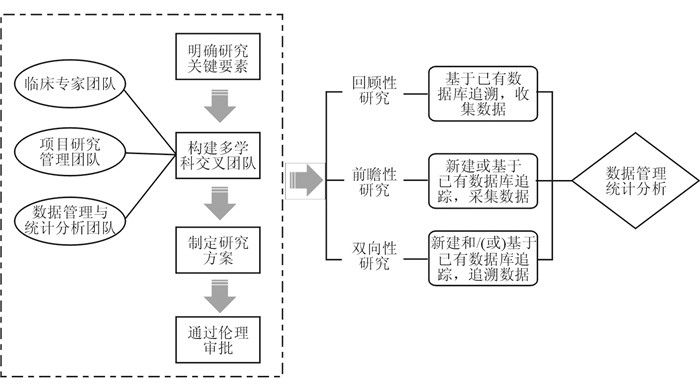
|
| 图 1 博鳌乐城创新药械现实世界数据研究模式推广图 |
美国对儿童临床研究领域的关注已有40余年历史,《21世纪治愈法案》中明确指出RWE可以支持药品或生物制品的儿科用途研究。美国国立卫生研究院资助的儿科试验网络计划(pediatric trials network,PTN)现已收录了100多个临床机构的儿科患者数据,其中的PTN电子健康记录数据库也有望应用于RWD分析。欧盟早在1998年便参与了ICH中儿科药物临床指南的探讨,2011年EMA启动欧洲儿科研究网络(Enpr-EMA),为RWE的应用奠定了坚实的数据基础。2020年我国正式发布《真实世界研究支持儿童药物研发与审评的技术指导原则(试行) 》,明确指出RWS可应用于我国儿童药物研发中包括新活性成分药品的上市后临床安全有效性研究、采用数据外推策略申报用于我国儿童、超说明书用药数据支持适应证扩展至儿童应用、罕见病以及其他等5种情形。
当前RWD已被广泛应用于儿科医药产品研发中,包括评估和验证儿科罕见病的生物标志物及预后指标、通过优化临床试验设计增加儿科患者的参与度、通过RWD外推目标人群支持扩大适应证、上市后安全性监测/药物警戒[20]。研究人员[21-22]考虑到儿科领域的特殊性,分析了RWE在儿科医药产品研发的实际应用中存在的诸多障碍,例如从子宫内药物暴露至儿童生长发育各个阶段的数据碎片化导致RWE来源与访问受限、儿科领域关键变量如儿童的出生日期、出生体质量、胎龄等因样本资料去识别化而丢失、儿科患者由于发育程度或认知限制无法进行自我报告从而影响获得准确的结局变量和不良反应、获得儿科患者知情同意困难等,提出一系列可行性建议:(1)应加强数据基础设施建设以解决儿科数据碎片化导致RWD利用度低的问题;(2)扩大通用数据模型应用;(3)充分利用现代技术,在不增加额外随访相关的研究负担前提下开发收集儿科患者纵向数据的方法,这对于儿科慢性疾病和儿科肿瘤领域尤为重要;(4)提高研究设计的合理性,在研究过程中与儿科患者及其父母良好沟通,建立信任等。史源等[23]以“新生儿无创呼吸支持研究”为例充分探讨了在临床和基础研究常落后于成人和儿童的新生儿中开展RWS的必要性。
2.4 在中医领域中的应用和策略中医是我国特有的传统医学,与现代医学相比,中医拥有其特有的诊疗模式和理论体系。传统的RCT不能体现中医的理论特色和优势,RWS以真实的临床研究环境为基础,在这一过程中,医务人员以改善和保障患者健康状态为目标,以患者为核心采取相应的干预治疗措施,这与中医的诊疗模式和理论体系不谋而合,RWS可充分发挥中医的理论特色[24-25]。当前,RWS在中医领域主要应用于以下几种场景:(1)用于中药新药的研发,RWS可在体现中医药内涵的基础上评估药物的有效性,全面获得临床疗效的“伴随特征”,如当出现某种证候时,使用该药疗效更佳等[26];(2)中药注射剂上市后再评价,中成药的治疗特点为辨证论治、综合调节,将RWS应用于中成药的上市后再评价,是符合中药本身固有特点的[27];(3)中医证候特征与证治规律研究,中医证候具有复杂性、非线性、模糊性的特点,以真实临床诊疗环境下的大数据为基础的RWS是进行中医证候特征研究的重要研究方法[27];(4)中医病证诊疗指南的适用性分析;(5)名老中医经验传承,研究人员[28]提出了基于现实世界的名中医经验数据挖掘思路。
虽然RWS以其特有的理论优势在中医领域得到广泛应用,但与其他领域一样,受技术发展和认识所限仍存在很多不足[29],需要特别关注以下几点。(1)目前RWS主要集中在中药注射液的上市后安全性再评价,针对口服中成药疗效和安全性评价较少,对名老中医经验的继承总结不足,传统中药饮片和中药配方颗粒的安全性尚未开展相关研究,缺乏中药饮片、中药配方颗粒与其他药物相互作用的研究,需要加快推进RWS在各领域的应用研究。(2)由于RWS自身的局限性和中医个体化干预的多样性,RWD来源广泛的同时也带来了大量的混杂偏倚,尤其是中药新药的RWS因其涵盖了关于证候、合并使用的其他中医药干预措施等数据,加之中医辨证标准难以统一,这些都限制了RWS在中医领域的应用。因而非常有必要推进中医RWD标准化采集和数据处理方法研究,突出中医药特色和优势,促进临床医生、循证医学专家,统计学专家多学科的交流合作,推动RWS在中医药领域的应用与发展。
3 RWD转化为证据的应用策略案例剖析在临床研究逐渐全球化的当下,医疗卫生行业各领域致力于RWD转化的应用策略探索,在如何获取适用的高质量证据方面做了不少大胆创新的尝试。本文就近年来较为典型的3个RWS案例从方法层面加以剖析(表 1),以期为构建RWS的良性生态圈提供实战化指导。
| 指标 | 案例1 | 案例2 | 案例3 |
| 项目名称 | 不同剂量阿司匹林预防心血管疾病的比较[30] | 国产新冠疫苗克尔来福在智利的保护效果评估[31] | RCT DUPLICATE项目 —重复CAROLINA RCT[32] |
| 研究背景 | 适当剂量的阿司匹林可以降低死亡、心梗和中风的风险,并尽量减少动脉粥样硬化性心血管疾病患者的大出血这一观点是有争议的。 | 已完成在中国人群中的1、2期临床试验,3期临床试验目前正在巴西、智利、印度尼西亚和土耳其进行。 | 为了更好的推动RWE在临床决策中的应用。CAROLINA RCT旨在评估利格列汀与格列美脲对早期2型糖尿病患者发生心血管事件的影响。 |
| 研究目的 | 比较2种不同剂量阿司匹林在二级预防心血管疾病方面的效益和长期有效性。 | 评估新冠疫苗在现实世界中的保护效果。 |
利用RWD构建非随机的观察性研究,来重复CAROLINA RCT的结果。 |
| 研究设计 | 随机、开放、多中心PCT | 前瞻性队列研究 | 回顾性队列研究 |
| 样本量 | N=15 076, 81 mg组7 540例、325 mg组7 536例 |
N=1 019万, 547.2万没有接种、54.2万接种一剂、417.4万完成两剂接种 | N=16 4176。24 842例使用利格列汀, 139 334例使用格列美脲 |
| 研究结果 | 在已确诊心血管疾病患者的常规护理中,有大量随机分配到325 mg/d组患者最终转为81 mg/d,在心血管事件或大出血方面随机分配的两组间差异无统计学意义。 | 该疫苗在预防重症和死亡方面非常有效,与已完成的2期临床试验结果以及正在进行的3期试验初步效果数据一致。 |
与格列美脲相比,利格列汀与心血管结局的风险无显著相关[HR=0.91,95% CI(0.79, 1.05)],结果符合CAROLINA试验的非劣效性假设。 |
| 证据转化策略 | 采用PCT设计,通过一系列创新和低成本的方法来简化患者的识别、招募和随访。 |
通过行政干预获得国家级层面的前瞻性队列,在现实世界中评估疫苗保护效果,对3期临床试验验证的保护效力作必要补充。 |
在CAROLINA RCT完成之前利用美国2个商业健康保险索赔数据库和按服务收费的医疗保险索赔数据库来预测CAROLINA试验在现实世界中的结果。 |
| 现实意义 | 转组差异导致阴性的研究结果并不能确证2个剂量之间没有差异;进一步证实了随机对照试验基本设计原则的重要性;展示了一种高效、低成本进行试验的方法。 | 新冠疫苗在经历了紧急使用、附条件上市和正式批准上市的过程中,RWD证据转化是其中必不可少的一个关键环节。 |
来自医疗数据库的高质量非随机化研究可以通过补充RCT的证据,辅助医疗服务提供者的治疗决策,帮助改善患者健康状况。 |
案例1是基于当前存在的争议观点开展的一项以患者为中心的大型实用性临床研究,属于干预性研究。需要关注的是研究者采用了一系列创新和低成本的方法来简化患者的识别、招募和随访,例如,在以患者为中心的临床网络PCORnet中使用算法询问电子健康记录数据以识别合格的患者;患者可以访问门户网站签署电子知情同意并获取他们被随机分配的阿司匹林方案(但需要自己购买);所有的研究访视都是基于网络或通过电话进行的,结局可以远程确认,无需仲裁。以上措施被认为在美国具有里程碑意义:证明大型实用性随机试验可以作为研究工具在美国实施,正如英国的ASCEND研究、欧洲的TASTE研究等。然而,也正是由于研究的实用性,最终被分配到325 mg/d组的患者41.6%最终转为81 mg/d,反之,仅7.1%由81 mg组转为325 mg/d,且大多数这样的转换发生在随机化分组后1~ 3周。这样的差异带来的问题是,即使得到了阴性的研究结果却并不能确证2个剂量之间没有差异。
作为一项新型疫苗附条件上市后的RWS,案例2的优势在于这是一个国家级层面的前瞻性队列:(1)使用了健全的行政卫生保健数据集,覆盖了约智利80%的人口;(2)在社区传播率最高的大流行时期开展的快速疫苗接种期间收集数据,使得可在相对较短的随访期估计基本的保护效果;(3)拉丁美洲的智利是COVID-19检测率最高的地区,拥有能够获得全民保健信息以及标准化的生命统计公共报告系统,较好的数据质量减少了未发现或未确定的病例和死亡的数量。
RCT DUPLICATE项目是由哈佛的研究团队于2018年率先发起,通过利用RWD构建非随机的观察性研究,来重复随机对照试验的结果,以期推动RWE在临床决策中的应用,共包含4个子项目。不同于前2个案例均为实际开展的前瞻性临床研究,作为RCT DUPLICATE项目中的一个子项目,案例3完全基于已有的数据库信息,当项目组确定好RWD关注的研究问题、筛选好待重复的RCT、匹配到合适的数据源后即可按既定的计划进行RWD分析,以期获得决策支持性结果。需要注意的是,该项目是在RCT完成之前对其进行重复和预测,这个策略很好地避免了事后重现的主观性偏倚。RCT-DUPLICATE项目的推进有助于增强人们对RWD研究的接受度和信心,从而促进RWD转化为RWE。
以上3个案例分别代表了RWS最典型的研究类型,根据不同的研究目的,从不同的角度展现了RWD证据转化的应用策略:(1)不同于一般治疗类药物,对于预防类新型疫苗,在通过Ⅲ期临床试验保护效力评估后,在现实世界中对RWD进行证据转化以评估临床保护效果,是必不可少的一个关键环节。但即使采用了国家级层面的前瞻性队列并有较好的数据质量,同样也存在RWS不可避免的混杂偏倚问题,需要在后期数据分析时采用合适的统计方法进行校正,并对结果谨慎解释和深入讨论。(2)当需要通过RWS对现存的争议观点进行验证时,可以借鉴案例1高效、低成本的研究执行策略,但需要结合当地实际情况作相应调整。考虑到我国当前医疗数据采集模式,现阶段进行大规模应用还较为困难,但对于小规模或仅限于某个医院内部的RWS很有借鉴价值。(3)案例3的实施基本不受条件限制,是每位研究者都可以学习借鉴的研究策略,需要关注的是基于的医疗数据库信息是否准确全面,若不能完全重复,其间的差异及带来的影响如何通过统计学方法来判断和校正。
4 讨论医学研究方法学的内在需求与信息技术相碰撞,资源开始向应用转化,RWD开始向临床研究证据转化,两者呈现出协同发展的态势。随着科学技术的不断发展,大数据技术、人工智能、新型医疗设备等可分析海量数据,对获取更多的不同于临床试验数据的RWD提供了极大的便利和可能,而这也是RWS蓬勃发展的主要原因。规范化的RWS有助于循证医学证据链的补充和完善,这就需要更加专业细化的指导原则、专家共识和行业指南的指导。例如孙鑫等[33]提出,制定符合国际标准的中成药真实世界研究规范将有力促进我国中成药高质量临床研究证据的产出和决策转化。未来的临床研究需要多学科的交叉融合、多领域专家的观点碰撞,才能可持续的向高质量证据推进。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
SHERMAN R E, ANDERSON S A, DAL PAN G J, et al. Real-world evidence-what is it and what can it tell us?[J]. N Engl J Med, 2016, 375(23): 2293-2297.
[DOI]
|
| [2] |
KAPLAN N M, SPROUL L E, MULCAHY W S. Large prospective study of ramipril in patients with hypertension. CARE Investigators[J]. Clin Ther, 1993, 15(5): 810-818.
|
| [3] |
Food and Drug Administration. Use of real-world evidence to support regulatory decision-making for medical devices: draft guidance for industry and Food and Drug Administration staff[EB/OL]. https://www.fda.gov/media/99447/download.
|
| [4] |
Network for Excellence in Health Innovation. Real world evidence: a new era for health care innovation[EB/OL]. https://www.nehi-us.org/publications/66-real-world-evidence-a-new-era-for-health-care-innovation/view.
|
| [5] |
US. Government. 21st century cures act[EB/OL]. https://www.congress.gov/bill/114th-congress/housebill/6?q=%7B%22search%22%3A%2221st+Century+Cures+Act%22%7D&s=8&r=5.
|
| [6] |
CAVE A, BRUN N C, SWEENEY F, et al. Bigdata-how to realize the promise[J]. Clin Pharmacol Ther, 2020, 107: 753-761.
[DOI]
|
| [7] |
BRECKENRIDGE A M, BRECKENRIDGE R A, PECK C C. Report on the current status of the use of real-world data (RWD) and real-world evidence (RWE) in drug development and regulation[J]. Br J Clin Pharmacol, 2019, 85(9): 1874-1877.
[DOI]
|
| [8] |
CENTER FOR DRUG EVALUATION, NMPA. Real-world data guidelines for generating real-world evidence (Trial version)[EB/OL]. https://www.cde.org.cn/main/news/viewInfoCommon/2a1c437ed54e7b838a7e86f4ac21c539.
|
| [9] |
WANG M H, ZHAO Y, DENG Y Z, et al. Comparison of policies and guidelines regarding using of real world data/real word evidence[J]. Chin J Clin Pharmacol Ther, 2020, 25(8): 878-889.
|
| [10] |
ROBERT HONIGBERG M, NEIL BELSON J. Contemporary applications of real-world evidence in regulatory decision making: a case series review[EB/OL]. https://medicalaffairs.org/real-world-evidence-regulatory-decision-making/.
|
| [11] |
边蕾, 赵频, 杨悦. FDA前哨行动运行情况研究与启示[J]. 中国药物警戒, 2013, 10(1): 25-29. BIAN L, ZHAO P, YANG Y. The Research of operating conditions of FDA sentinel initiative and enlightenment[J]. Chinese Journal of Pharmacovigilance, 2013, 10(1): 25-29. [DOI] |
| [12] |
RATH A, SALAMON V, PEIXOTO S, et al. A systematic literature review of evidence-based clinical practice for rare diseases: what are the perceived and real barriers forimproving the evidence and how can they be overcome?[J]. Trials, 2017, 18(1): 556.
[DOI]
|
| [13] |
孙宇昕, 魏芬芳, 杨悦. 真实世界证据用于药械监管与卫生决策的机遇与挑战[J]. 中国药物警戒, 2017, 14(6): 353-358. SUN Y X, WEI F F, YANG Y. Opportunities and challenges for real-world evidence applied in drug regulation and health decision making[J]. Chinese Journal of Pharmacovigilance, 2017, 14(6): 353-358. [DOI] |
| [14] |
LI M, CHEN S, LAI Y, et al. Integrating real-world evidence in the regulatory decision-making process: a systematic analysis of experiences in the US, EU, and China using a logic model[J]. Front Med (Lausanne), 2021, 8: 669509.
|
| [15] |
吴宏辉, 宋海波, 张力, 等. 欧盟药品上市后有效性研究管理制度简介[J]. 药物评价研究, 2021, 44(6): 1134-1140. WU H H, SONG H B, ZHANG L, et al. Introduction of post-authorisation efficacy study management system in European Union[J]. Drug Evaluation Research, 2021, 44(6): 1134-1140. [CNKI] |
| [16] |
莫成林, 连桂玉. 真实世界研究支持孤儿药审评审批的质量风险考量[J]. 质量与市场, 2020(16): 62-64. MO C L, LIAN G Y. Quality risk consideration of orphan drug review and approval supported by real-world research[J]. Quality and market, 2020(16): 62-64. [CNKI] |
| [17] |
NMPA. Technical guidelines for clinical evaluation of medical devices using real-world data. (Trial version)[EB/OL]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20201126090030150.html.
|
| [18] |
刘露, 钟佑锦, 张宇晶, 等. 真实世界证据与医疗器械上市前临床评价: 思考与建议[J]. 中国循证医学杂志, 2019, 19(8): 883-886. LIU L, ZHONG Y J, ZHANG Y J, et al. The consideration and suggestion of real-world evidence and pre-marketing evaluation of medical devices[J]. Chinese Journal of Evidence-Based Medicine, 2019, 19(8): 883-886. [CNKI] |
| [19] |
任燕, 梁远波, 刘密密, 等. 构建博鳌乐城创新药械真实世界数据研究体系: 基于我国首个使用境内真实世界数据获批上市的医疗器械研究的探讨[J]. 中国循证医学杂志, 2020, 20(10): 1117-1123. REN Y, LIANG Y B, LIU M M, et al. Exploration and practice of real-world data studies on innovative medical products in Boao Lecheng: analysis based on Chinese first case of approved medical device using domestic real-world data[J]. Chinese Journal of Evidence-Based Medicine, 2020, 20(10): 1117-1123. [CNKI] |
| [20] |
王雪, 杨悦. 真实世界证据应用于儿科医药产品研发中的挑战及对策研究[J]. 中国药房, 2021, 32(10): 1165-1172. WANG X, YANG Y. Research on challenges and policies of real-world evidence applied in pediatric medical product R & D[J]. China Pharmacy, 2021, 32(10): 1165-1172. [DOI] |
| [21] |
BEVANS K B, RILEY A W, MOON J, et al. Conceptual and methodological advances in child-reported outcomes measurement[J]. Expert Rev Pharmacoecon Outcomes Res, 2010, 10(4): 385-396.
[DOI]
|
| [22] |
CARPENTER D, GONZALEZ D, RETSCH-BOGART G, et al. Methodological and ethical issues in pediatric medication safety research[J]. Pediatrics, 2017, 140(3): e20170195.
[DOI]
|
| [23] |
史源, 陈妍如, 陈龙. 真实世界研究在新生儿医学中的应用[J]. 中国当代儿科杂志, 2018, 20(3): 169-173. SHI Y, CHEN Y R, CHEN L. Application of real world study in neonatal medicine[J]. Chin J Contemp Pediatr, 2018, 20(3): 169-173. [CNKI] |
| [24] |
李晓春, 戴国华, 刘小翠. 基于HIS真实世界研究方法及其在中医临床疗效评价中的应用[J]. 山东中医药大学学报, 2016, 40(5): 415-418. LI X C, DAI G H, LIU X C. Real world study methods and its application in clinical efficacy evaluation of traditional Chinese medicine based on HIS[J]. Journal of Shandong University of Traditional Chinese Medicine, 2016, 40(5): 415-418. [CNKI] |
| [25] |
刘保延. 真实世界的中医临床科研范式[J]. 中医杂志, 2013, 54(6): 451-455. LIU B Y. Real-world traditional Chinese medicine clinical research paradigm[J]. Journal of Traditional Chinese Medicine, 2013, 54(6): 451-455. [CNKI] |
| [26] |
戴亮, 季光. 基于FDA《真实世界证据计划框架》论析真实世界研究对中药新药研发的意义[J]. 中药新药与临床药理, 2019, 30(11): 1403-1408. DAI L, JI G. Status and value of real world study on research and development of new chinese medicine-interpreting framework for FDA's real-world evidence program[J]. Traditional Chinese Drug Research & Clinical Pharmacology, 2019, 30(11): 1403-1408. [CNKI] |
| [27] |
邢永发, 王保和, 黄宇虹. 真实世界研究在中医药临床评价方面应用进展及数据质控[J]. 环球中医药, 2018, 11(4): 625-630. XING Y F, WANG B H, HUANG Y H. Research progress and data quality control of application of real-world study on clinical evaluation of traditional Chinese medicine[J]. Global Traditional Chinese Medicine, 2018, 11(4): 625-630. [DOI] |
| [28] |
周强, 朱彦, 朱春洋, 等. 基于真实世界的名中医经验数据挖掘思路初探[J]. 中国中西医结合消化杂志, 2017, 25(10): 793-795. ZHOU Q, ZHU Y, ZHU C Y, et al. The method of mining clinical experience based on real-world data[J]. Chin J Integr Trad West Med Dig, 2017, 25(10): 793-795. [CNKI] |
| [29] |
XING D M, LI C X, LIU X C, et al. Problems and strategies in the field of traditional Chinese medicine real-world study[J]. CJTCMP, 2021, 36(4): 1798-1801.
|
| [30] |
JONES W S, MULDER H, WRUCK L M, et al. Comparative effectiveness of aspirin dosing in cardiovascular disease[J]. N Engl J Med, 2021, 384(21): 1981-1990.
[DOI]
|
| [31] |
JARA A. Effectiveness of an inactivated SARS-CoV-2 vaccine in Chile[J]. N Engl J Med, 2021, 385(10): 875-884.
[DOI]
|
| [32] |
石舒原, 赵厚宇, 周庆欣, 等. 真实世界证据与随机对照试验: RCT DUPLICATE项目方法学介绍[J]. 药物流行病学杂志, 2019, 29(3): 198-205. SHI S Y, ZHAO H Y, ZHOU Q X, et al. Real-world evidence and randomized controlled trials: the methodology of RCT DUPLICATE[J]. Chin J Pharmacoepidemiol, 2019, 29(3): 198-205. [CNKI] |
| [33] |
孙鑫, 张俊华, 王雯, 等. 制定中国中成药真实世界研究技术指导原则, 促进中成药临床研究向决策证据转化[J]. 中国循证医学杂志, 2020, 20(9): 993-999. SUN X, ZHANG J H, WANG W, et al. Formulate technical guidance for real-world studies of traditional Chinese medicine in China to promote the transformation of clinical research of Chinese patent medicine into decision evidence[J]. Chinese Journal of Evidence-Based Medicine, 2020, 20(9): 993-999. [CNKI] |
 2021, Vol. 28
2021, Vol. 28


