黏膜相关淋巴组织(mucosa-associated lymphoid tissue,MALT)淋巴瘤是边缘区淋巴瘤最常见的一种亚型,是一种临床病理特征独特的相对惰性的非霍奇金淋巴瘤,属于慢性B淋巴细胞增殖性疾病(B cell chronic lymphoproliferative disease, B-CLPD)[1]。肺部是MALT淋巴瘤常见的累及部位之一。肺MALT淋巴瘤也是肺非霍奇金淋巴瘤最常见的组织学亚型,占70%~90%[2]。其标准化治疗迄今仍存在较多争议,尚无统一定论。对于新诊断的肿瘤负荷重的肺MALT淋巴瘤患者,如何选择更有效的治疗方案,获得更好的临床缓解,几乎无可参考的数据。本研究回顾性分析了77例初诊肺MALT淋巴瘤的临床及随访资料,旨在探讨其临床特征及预后。
1 资料与方法 1.1 一般资料回顾性分析2013年1月至2020年6月复旦大学附属中山医院血液科收治的77例初发肺MALT淋巴瘤患者的临床资料。所有患者均经活检病理证实,根据2016年版WHO造血与淋巴组织肿瘤分类标准[3],确诊为肺MALT淋巴瘤。临床分期采用AnnArbor分期[4],患者一般情况评价采用美国东部肿瘤合作组(Eastern Cooperative Group,ECOG)评分,预后因素采用MALT-IPI评分[5]。本研究经医院伦理委员会审核批准(B2017-033R),所有患者均知情并签署知情同意书。
1.2 观察指标总结分析77例肺MALT淋巴瘤患者基线资料及治疗数据。(1)基线资料:性别、确诊年龄、临床表现、疾病分期、病理、MALT1基因突变、肝肾功能、免疫球蛋白、β2微球蛋白、免疫固定电泳、乳酸脱氢酶、C-反应蛋白、抗核抗体、PET-CT等。(2)治疗资料:一线治疗方案,包括手术、放疗、化疗方案等。(3)生存情况:通过患者门诊、住院病历或电话随访生存情况,包括无进展生存期(progression free survival, PFS)及总生存期(overall survival, OS)。OS指从疾病确诊至患者死亡或观察截止的时间。PFS指从疾病确诊至发生进展的时间,同时计算POD24指标,POD24指进展时间短于24个月(progression of disease within 24 months)。
1.3 统计学处理采用SPSS 20.0统计软件进行数据分析。符合正态分布的计量资料以x±s表示,不符合正态分布的计量资料以M(P25,P75)表示。生存分析采用Kaplan-Meier法。检验水准(α)为0.05。
2 结果 2.1 一般资料分析结果(表 1)显示:77例肺MALT淋巴瘤患者中,男性32例(41.6%),女性45例(58.4%),中位发病年龄为59(24~85)岁。肺占位患者32例(41.6%),症状起病患者45例(58.4%),主要表现为肺部非特异性症状,咳嗽27例,咳痰12例,胸闷8例,胸痛7例,气促8例,盗汗1例,发热6例,痰血5例,进食哽咽感1例,声音嘶哑1例。77例患者均经病理免疫组化染色确诊为肺MALT淋巴瘤,Ki-67分布范围2%~60%,均无组织学转化。52例患者行原位荧光杂交(FISH)MALT1(18q21)分离探针,其中26例阳性(50%),提示存在MALT1/API2基因异常。所有患者均行骨髓穿刺、PET-CT等检查全面评估病情。根据AnnArbor分期,临床分期为Ⅰ/Ⅱ期患者共17例,Ⅲ/Ⅳ期患者共60例。
| 指标 | 结果n(%) |
| 性别 | |
| 男 | 32(41.6) |
| 女 | 45(58.4) |
| 年龄≥70岁 | 10(13.0) |
| 起病情况 | |
| 检查发现肺病灶 | 32(41.6) |
| 症状起病 | 45(58.4) |
| 存在B症状 | 15(19.5) |
| LDH≥245 U/L* | 8(10.4) |
| β2微球蛋白≥3.5 mg/L* | 9(11.7) |
| IgG≥17.4 g/L*或IgM≥2.2 g/L* | 17(22.1) |
| 免疫固定电泳阳性 | 21(27.3) |
| CRP>3.0 g/L* | 29(37.6) |
| TNF-α≥8 pg/mL* | 24/45(55.5) |
| IL-2R>710 U/mL* | 22/66(33.3) |
| 自身免疫性疾病 | 5(6.5) |
| ANA异常 | 45(58.4) |
| 其他自身抗体异常 | 28(36.4) |
| 骨髓受累 | 9(11.7) |
| MALT1基因异常 | 26/52(50.0) |
| AnnArbor分期 | |
| Ⅰ | 14(18.2) |
| Ⅱ | 3(3.9) |
| Ⅲ | 1(1.3) |
| Ⅳ | 59(76.6) |
| MALT-IPI评分 | |
| 0 | 15(19.5) |
| 1 | 45(58.4) |
| 2 | 17(22.1) |
| LDH: 乳酸脱氢酶;CRP: C-反应蛋白;TNF-α: 肿瘤坏死因子α;ANA: 抗核抗体;*参考范围设定依据本中心指标正常范围上限。 | |
结果(表 2)显示:77例患者中,手术治疗19例,化疗治疗43例,观察随访15例。根据不同分期,Ⅰ/Ⅱ期患者中,接受手术治疗12例,接受化疗3例,2例经评估后观察随访。Ⅲ/Ⅳ期患者中,7例接受手术,40例接受化疗,13例观察随访(其中8例患者经评估后进入随访,3例抗炎治疗后进入随访,2例拒绝治疗)。中位随访时间为35.3(5.5~96.0)个月。一线治疗后最佳疗效,25例(32.5%)完全缓解(complete response, CR),31例(40.2%)部分缓解(parital response, PR),16例(20.8%)疾病稳定(stable disease, SD),2例(2.6%)病情进展(progressive disease, PD),总体反应率72.7%。结束治疗后继续随访过程中,14例患者复发进展。截至随访终止时间,一线治疗后16例患者(20.8%)发生疾病进展/复发。
| 治疗措施 | 例数n(%) | 疗效n(%) | |||
| CR | PR | SD | PD | ||
| 手术 | 19(24.7) | 11(14.3) | 2(2.6) | 6(7.8) | |
| 化疗 | |||||
| RC | 24(31.1) | 5(6.5) | 16(20.7) | 3(3.9) | |
| R-CHOP | 12(15.6) | 3(3.9) | 4(5.2) | 2(2.6) | 3(3.9) |
| 其他 | 7(9.1) | 1(1.3) | 2(2.6) | 3(3.9) | 1(1.3) |
| 观察随访 | 15(19.5) | 12(15.6) | 3(3.9) | ||
| RC: 克拉屈滨联合利妥昔单抗;R-CHOP: 利妥昔单抗联合环磷酰胺、蒽环类药物/脂质体多柔比星、长春地辛、强的松;CR:完全缓解;PR: 部分缓解;SD: 疾病稳定;PD:疾病进展。 | |||||
接受手术治疗组最佳疗效,15例(78.9%)达CR,4例(21.1%)达PR,随访期间6例(31.6%)PD。接受化疗治疗组,化疗方案主要包括RC(克拉屈滨联合利妥昔单抗)、R-CHOP(利妥昔单抗联合环磷酰胺、蒽环类药物/脂质体多柔比星、长春地辛、强的松)、R2(来那度胺联合利妥昔单抗)、BR(苯达莫司汀联合利妥昔单抗)等。24例患者接受RC方案化疗,12例患者接受R-CHOP方案化疗,7例患者接受R2、BR等方案化疗。化疗治疗组,7例PD患者均在治疗过程中出现疾病进展,总体反应率为72.1%。
2.3 生存及预后分析随访截止时间为2020年11月20日,中位随访35.3(5.5~96.0)个月,疾病特异中位OS及PFS均未达到,5年OS率为95.1%,5年PFS率为73.2%。结果(图 1)显示:AnnArbor分期Ⅰ/Ⅱ期和Ⅲ/Ⅳ期患者的OS和PFS差异均无统计学意义(P=0.455、0.834)。
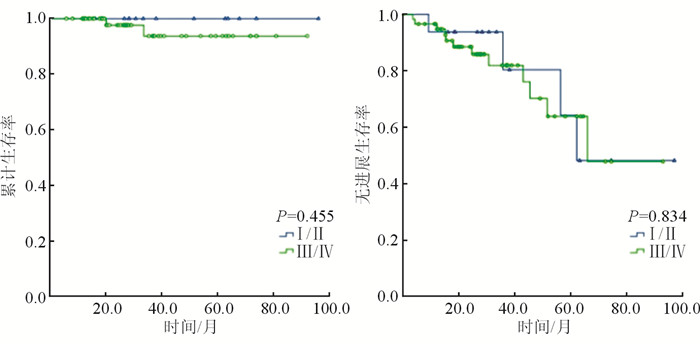
|
| 图 1 AnnArbor分期Ⅰ/Ⅱ期和Ⅲ/Ⅳ期患者的OS(左)和PFS(右) |
结果(图 2)显示:尽管接受不同方案治疗患者的OS差异无统计学意义(P=0.061),但接受全身化疗患者可能获得更长的PFS,单纯手术治疗可能与较差的PFS相关(P=0.004)。
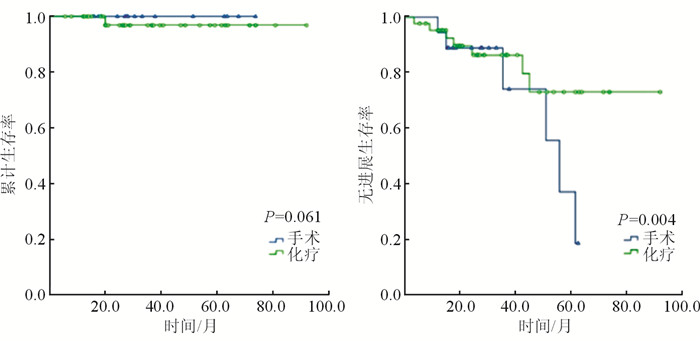
|
| 图 2 77例肺MALT淋巴瘤不同治疗方案的OS(左)和PFS(右) |
但由于接受手术治疗及化疗的患者通常处于不同疾病分期,故对于Ⅰ/Ⅱ期患者单独进行了不同治疗方案的PFS分析。结果(图 3)显示:Ⅰ/Ⅱ期患者接受不同方案治疗后,PFS远期趋势同整体人群相当。
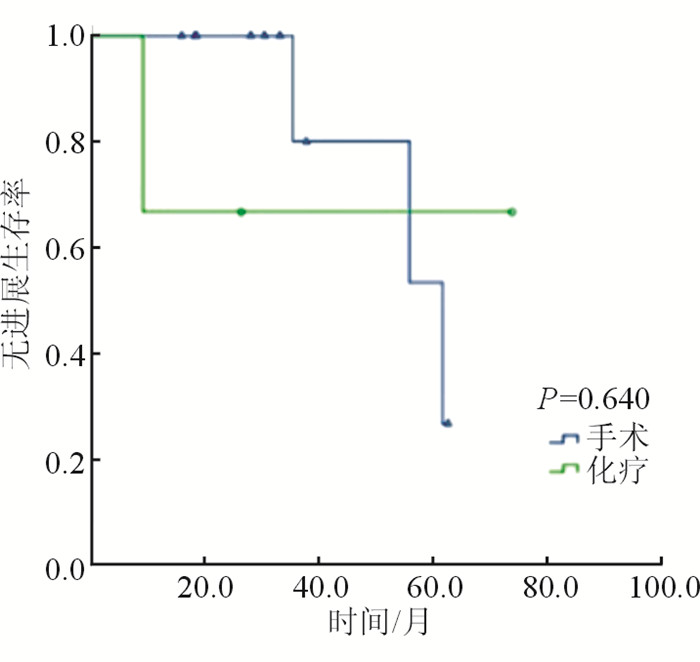
|
| 图 3 Ⅰ/Ⅱ期患者接受手术和化疗的PFS |
77例患者中,53例患者可计算POD24,7例患者POD24阳性。POD24与OS的Kaplan-Meier曲线结果(图 4)显示:POD24是肺MALT淋巴瘤预后不良OS的危险因素(P=0.046)。
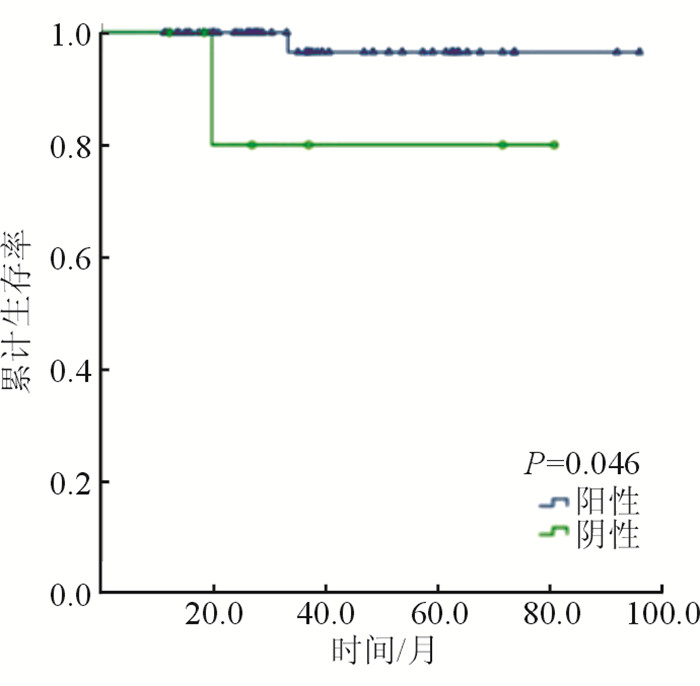
|
| 图 4 POD24阳性与肺MALT淋巴瘤的OS |
肺MALT淋巴瘤是黏膜相关淋巴组织淋巴瘤中常见的亚型,是一种惰性淋巴瘤,疾病进程缓慢,Ki-67增殖指数通常较低,30%~50%患者存在MALT1/API2基因异常[6]。在肺非霍奇金淋巴瘤中,肺MALT淋巴瘤是最常见的组织学亚型,占70%~80%[2]。肺MALT淋巴瘤主要发生在60岁以上的患者,女性略多于男性。大多数患者无症状,体检行胸部影像学检查发现异常而就诊。起病时有症状的患者,通常表现为非特异性肺部症状,其中最常见的为咳嗽、胸痛、呼吸困难等[7]。本中心在2013年1月至2020年6月收治的初发肺MALT淋巴瘤患者77例,基线情况与既往研究数据相仿,中位发病年龄为59岁,女性患者略多于男性,症状起病患者45例(58.4%),均表现为肺部非特异性症状。
肺MALT淋巴瘤的发病通常与慢性炎症相关,在持续抗原刺激下,异常克隆发生一系列遗传突变并逐渐替代炎症组织中正常B细胞群,从而导致淋巴瘤的发生[8]。作为MALT最常累及的病灶之一,肺MALT淋巴瘤的发病同样与慢性炎症刺激相关。有少数文献[9]报道,肺MALT淋巴瘤可能与木糖氧化无色杆菌感染相关。本研究中的部分患者既往存在自身免疫性疾病,长期存在慢性炎症刺激,可能与肺MALT淋巴瘤的发生相关。
肺MALT淋巴瘤总体预后较好,5年生存率超过90%,中位生存期超过10年[10]。对于肺MALT淋巴瘤的标准化治疗,大宗样本病例报道少见,目前尚无统一定论,迄今仍存在较多争议。一项205例MALT淋巴瘤的回顾性研究[11]中,195例患者根据病情严重的程度接受了不同手术切除或烷化剂±美罗华方案化疗,10例随访观察。中位随访70个月,66例患者(32%)在一线治疗后发生疾病进展/复发[中位PFS 19个月(0~112个月)]。如何个体化选择更合适的系统化治疗方案,从而达到更好的预后,需要进一步研究。
有研究[12]认为,ⅠE期患者接受手术与未接受手术比较,无论是否术后化疗,接受手术切除患者的OS均明显长于未手术组,推荐ⅠE期患者手术治疗。局限性的病灶,比如仅单侧肺叶受累,可能是对手术、放疗等局部治疗反应较好的标志[13]。也有研究[14]认为,肺MALT淋巴瘤呈惰性病程,总体预后较好,接受手术或化疗对OS、PFS影响不大。本研究19例患者接受手术治疗,6例患者复发,生存分析提示远期PFS低于化疗组。手术治疗是创伤性操作,对于病灶局限的Ⅰ期患者,仍需谨慎考虑手术治疗是否为最佳选择,需充分考虑术后并发症、肺功能受损等情况,评估若不经手术治疗是否亦能达到良好的远期预后[15]。
肺MALT淋巴瘤的化疗方案参照非胃MALT淋巴瘤,包括R-CHOP、R单药、伊布替尼、R2、BR等方案,同时考虑年龄、合并症及未来进一步治疗的可能性,个体化制订化疗方案。文献[16]报道,R2方案治疗MZL有效率高,ORR可达93%,疗效持续,安全性可控。单药伊布替尼治疗复发难治MZL可诱导持久的应答,并具有有利的获益风险[17]。MALT2008-01临床试验[18]结果显示,BR方案一线治疗MALToma,2年及4年无事件生存期(event free survival, EFS)分别为93%和88%,安全性良好。但目前多个临床试验对象均为惰性B细胞淋巴瘤,包含MZL病例数较少,需要更多临床治疗数据进一步验证。本研究接受化疗治疗的43例患者,化疗方案均为包含利妥昔单抗的方案,主要包括RCHOP、RC等,另有少数病例接受R2、BR方案治疗,总体均获得了较好的疗效及预后。
肺MALT淋巴瘤为惰性淋巴瘤,总体病程进展缓慢,PFS是预测OS较好的指标。POD24指24个月内疾病发生进展,是反映PFS的指标之一。POD24与OS的关系已在滤泡淋巴瘤、套细胞淋巴瘤等B细胞淋巴瘤中得到证实[19-20]。近期,国外亦有研究[21]分析POD24在边缘区淋巴瘤中与OS的关系,并得到了肯定的结果。但POD24不能作为早期指导治疗决策的指标。本研究肺MALT淋巴瘤患者POD24同样是OS的危险因素(P=0.046)。
综上所述,接受化疗治疗患者远期PFS优于手术治疗组,对于AnnArbor分期Ⅰ/Ⅱ期患者接受不同治疗的PFS趋势与整体一致,POD24阳性是不良OS的危险因素。由于本研究纳入病例数相对较少,分层后组内病例数较少,因此研究结果存在偏倚可能,上述结论尚需要进一步累积样本量后分析及验证。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
ISAACSON P G, SPENCER J. Malignant lymphoma of mucosa-associated lymphoid tissue[J]. Histopathology, 1987, 11(5): 445-462.
[DOI]
|
| [2] |
PIÑA-OVIEDO S, WEISSFERDT A, KALHOR N, et al. Primary pulmonary lymphomas[J]. Adv Anat Pathol, 2015, 22(6): 355-375.
[DOI]
|
| [3] |
SWERDLOW S H, CAMPO E, PILERI S A, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms[J]. Blood, 2016, 127(20): 2375-2390.
[DOI]
|
| [4] |
FISHER R I. Overview of non-Hodgkin's lymphoma: biology, staging, and treatment[J]. Semin Oncol, 2003, 30(2 Suppl 4): 3-9.
|
| [5] |
THIEBLEMONT C, CASCIONE L, CONCONI A, et al. A MALT lymphoma prognostic index[J]. Blood, 2017, 130(12): 1409-1417.
[DOI]
|
| [6] |
BORIE R, WISLEZ M, ANTOINE M, et al. Pulmonary mucosa-associated lymphoid tissue lymphoma revisited[J]. Eur Respir J, 2016, 47(4): 1244-1260.
[DOI]
|
| [7] |
CORDIER J, CHAILLEUX E, LAUQUE D, et al. Primary pulmonary lymphomas. A clinical study of 70 cases in nonimmuno-compromised patients[J]. Chest, 1993, 103(1): 201-208.
[DOI]
|
| [8] |
FOO S Y, PHIPPS S. Regulation of inducible BALT formation and contribution to immunity and pathology[J]. Mucosal Immunol, 2010, 3(6): 537-544.
[DOI]
|
| [9] |
ADAM P, CZAPIEWSKI P, COLAK S, et al. Prevalence of Achromobacter xylosoxidans in pulmonary mucosa-associated lymphoid tissue lymphoma in different regions of Europe[J]. Br J Haematol, 2014, 164(6): 804-810.
[DOI]
|
| [10] |
ZHANG M C, ZHOU M, SONG Q, et al. Clinical features and outcomes of pulmonary lymphoma: a single center experience of 180 cases[J]. Lung Cancer, 2019, 132: 39-44.
[DOI]
|
| [11] |
SAMMASSIMO S, PRUNERI G, ANDREOLA G, et al. A retrospective international study on primary extranodal marginal zone lymphoma of the lung (BALT lymphoma) on behalf of International Extranodal Lymphoma Study Group (IELSG)[J]. Hematol Oncol, 2016, 34(4): 177-183.
[DOI]
|
| [12] |
YANG M, ZHAO S, ZHANG X, et al. Effects of microvascular density on primary pulmonary non-Hodgkin's lymphoma (PPL)[J]. Tumour Biol, 2012, 33(6): 2143-2150.
[DOI]
|
| [13] |
AHMED S, KUSSICK S J, SIDDIQUI A K, et al. Bronchial-associated lymphoid tissue lymphoma: a clinical study of a rare disease[J]. Eur J Cancer, 2004, 40(9): 1320-1326.
[DOI]
|
| [14] |
OH S Y, KIM W S, KIM J S, et al. Pulmonary marginal zone B-cell lymphoma of MALT type-what is a prognostic factor and which is the optimal treatment, operation, or chemotherapy?: Consortium for Improving Survival of Lymphoma (CISL) study[J]. Ann Hematol, 2010, 89(6): 563-568.
[DOI]
|
| [15] |
GRAHAM B B, MATHISEN D J, MARK E J, et al. Primary pulmonary lymphoma[J]. Ann Thorac Surg, 2005, 80(4): 1248-1253.
[DOI]
|
| [16] |
BECNEL M R, NASTOUPIL L J, SAMANIEGO F, et al. Lenalidomide plus rituximab (R2) in previously untreated marginal zone lymphoma: subgroup analysis and long-term follow-up of an open-label phase 2 trial[J]. Br J Haematol, 2019, 185(5): 874-882.
[DOI]
|
| [17] |
NOY A, DE VOS S, THIEBLEMONT C, et al. Targeting Bruton tyrosine kinase with ibrutinib in relapsed/refractory marginal zone lymphoma[J]. Blood, 2017, 129(16): 2224-2232.
[DOI]
|
| [18] |
SALAR A, DOMINGO-DOMENECH E, PANIZO C, et al. First-line response-adapted treatment with the combination of bendamustine and rituximab in patients with mucosa-associated lymphoid tissue lymphoma (MALT2008-01): a multicentre, single-arm, phase 2 trial[J]. Lancet Haematol, 2014, 1(3): 104-111.
[DOI]
|
| [19] |
TRACY S I, LARSON M C, FELDMAN A L, et al. The utility of prognostic indices, early events, and histological subtypes on predicting outcomes in non-follicular indolent B-cell lymphomas[J]. Am J Hematol, 2019, 94(6): 658-666.
[DOI]
|
| [20] |
VISCO C, TISI M C, EVANGELISTA A, et al. Time to progression of mantle cell lymphoma after high-dose cytarabine-based regimens defines patients risk for death[J]. Br J Haematol, 2019, 185(5): 940-944.
[DOI]
|
| [21] |
LUMINARI S, MERLI M, RATTOTTI S, et al. Early progression as a predictor of survival in marginal zone lymphomas: an analysis from the FIL-NF10 study[J]. Blood, 2019, 134(10): 798-801.
[DOI]
|
 2021, Vol. 28
2021, Vol. 28


