2. 上海市影像医学研究所, 上海 200032;
3. 国家放射与治疗临床医学研究中心, 上海 200032;
4. 复旦大学附属中山医院放射科, 上海 200032;
5. 复旦大学附属中山医院消化内科, 上海 200032
2. Shanghai Institution of Medical Imaging, Shanghai 200032, China;
3. National Clinical Research Center for Interventional Medicine, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
4. Department of Radiology, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
5. Department of Gastroenterology, Zhongshan Hospital, Fudan University, Shanghai 200032, China
食管胃底静脉曲张出血是门静脉高压的严重并发症,治疗后1~2年再出血率为60%~70%,病死率达33%[1-2]。因此,预防食管胃底静脉曲张再出血至关重要[3]。国内外临床实践[1, 3-4]均推荐将内镜治疗联合非选择性β受体阻滞剂(non-selective β-blockers,NSBBs)作为预防食管胃底静脉曲张再出血的一线标准疗法,将经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS)作为内镜治疗失败后的二线疗法。然而,即使接受标准二级预防治疗后,再出血率仍为42%~43%[5]。近年来,危险程度分级、精准个体医疗以及多学科合作逐步成为治疗门静脉高压出血的医疗模式。既往研究[6]表明,早期TIPS对伴有治疗失败高危因素的急性食管胃底静脉曲张出血患者疗效显著。然而,当静脉曲张出血患者伴有内镜联合药物治疗失败的高危因素时,TIPS作为二级预防的一线疗法的疗效尚不明确。
肝静脉压力梯度(hepatic vein pressure gradient,HVPG)反映门静脉与肝静脉的压力差,在肝硬化分期、并发症和疗效评估中有重要价值[7]。有研究[8]表明,急性食管胃底静脉曲张出血合并HVPG≥20 mmHg(1 mmHg=0.133 kPa)患者的治疗后1年再出血率及死亡率高于低HVPG患者。门静脉血栓(portal vein thrombosis,PVT)的发病率为10%~23%[9]。合并PVT时,患者需要接受更多次的内镜治疗才能去除静脉曲张;而NSBBs会降低内脏器官血流,使PVT再次形成。65%~85%的胃底静脉曲张合并胃肾分流(gastro-renal shunt,GRS)[10-11],有指南[12]推荐通过内镜下硬化剂注射治疗胃底静脉曲张,然而较高血流量的胃肾分流道可能造成异位栓塞[13-14]。此外,腔外侧支静脉(ep-GVs)可能增加再出血的风险,影响内镜治疗的疗效[15]。
聚四氟乙烯(polytetrafluoroethylene,PTFE)覆膜支架可以改善TIPS分流道的通畅性[16]。Viatorr覆膜支架作为TIPS专用PTFE覆膜支架,在临床逐步得到应用。本研究探讨TIPS术中植入Viatorr覆膜支架预防食管胃底静脉曲张合并HVPG ≥20 mmHg、PVT、GRS或ep-GVs患者再出血的临床疗效。
1 资料与方法 1.1 一般资料回顾性分析2015年11月至2018年12月复旦大学附属中山医院收治的240例肝硬化合并食管胃底静脉曲张患者的临床资料。术前向患者及家属详细介绍内镜联合NSBBs(普萘洛尔)治疗及TIPS治疗的利弊,并由患者及家属决定选择何种治疗,进而分为TIPS组(n=98)与内镜组(n=142),再根据4项高危因素分为HVPG、PVT、GRS、ep-GVs亚组。本研究通过复旦大学附属中山医院伦理委员会批准(B2021-244R),所有患者均签署手术知情同意书。
纳入标准:(1)依据临床表现、影像学检查及实验室检查或肝穿刺活检确诊为肝硬化;(2)年龄18~75岁;(3)经胃镜检查证实为食管胃底静脉曲张;(4)术前5~42 d静脉曲张出血;(5)Child-Pugh评分≤9分,总胆红素≤51 μmol/L,血肌酐浓度≤115 μmol/L;(6)合并HVPG≥20 mmHg、PVT、胃肾分流、腔道外侧支静脉等4个因素之一。排除标准:(1)同时合并上述4项高危因素中的2项或以上;(2)既往行静脉曲张再出血二级预防治疗、TIPS、手术分流、脾切术或脾脏栓塞术;(3)门静脉主干血栓狭窄率小于50%;(4)严重心肺系统疾病及感染性疾病;(5)术前严重肝性脑病病史;(6)肝恶性肿瘤及其他肝外恶性肿瘤;(7)合并普萘洛尔、抗凝药物及TIPS治疗禁忌证;(8)临床资料不完整。
1.2 治疗方法TIPS组:在分流道中植入Viatorr覆膜支架(Gore公司,美国),使用NBCA胶、弹簧圈或两者联合栓塞曲张静脉或异位分流道。对于合并PVT的患者,术后立即进行抗凝治疗。低分子肝素剂量为4 100 U, 每日2次,维持3~5 d。随后给予口服华法林治疗,起始剂量为2.5 mg/d,其后调整剂量使患者国际标准化比值(INR)维持在2~3。
内镜组:每隔14 d行1次内镜治疗,直至曲张静脉消失。普萘洛尔起始剂量为20 mg、每日2次,调整剂量至患者心率降至55次/min或降低基础心率的25%,或患者最大耐受剂量。对于合并PVT患者,曲张静脉消失后行华法林治疗,用法与TIPS治疗后相同。
1.3 术后随访术后1、3、6个月随访1次,后每6个月随访1次。随访内容包括临床症状、生化指标、超声结果及CT检查结果。对于TIPS组患者,如果怀疑分流道狭窄,则行分流道DSA检查,必要时进行球囊扩张或植入新的覆膜支架。对于内镜组患者,发现新的曲张静脉时,行内镜下套扎术或硬化剂注射术。
1.4 观察指标研究终点为静脉曲张再出血、肝性脑病、总体生存。将West-Haven分级标准[17]中2~4级肝性脑病归为显性肝性脑病。出现需要入院治疗、需要输血、血红蛋白下降3 g/L及以上、6周内死亡4项之一的反复黑便或呕血定义为再出血[18]。
1.5 统计学处理采用SPSS 22.0和GraphPad Prism 8.0进行数据分析。符合正态分布的计量资料以±s表示,组间比较采用t检验。分类变量以n(%)表示,组间比较采用χ2检验。用Kaplan-Meier曲线分析患者生存率、无再出血累计生存率和无肝性脑病累计生存率,组间比较采用log-rank检验。使用Cox回归模型进行相关因素分析,将单因素分析中P < 0.1的变量纳入多因素回归模型,分析预后独立预测因素。检验水准(α)为0.05。
2 结果 2.1 一般资料分析患者筛选及分组过程见图 1。符合纳入标准者240例,其中98例患者接受TIPS治疗(TIPS组),142例患者接受内镜联合药物治疗(内镜组);2组患者各根据4项高危因素分为HVPG、PVT、GRS、ep-GVs亚组。结果(表 1、表 2)显示:TIPS组患者年龄大于内镜组患者(P=0.036);其余指标在2组及对应亚组间差异均无统计学意义。2组患者术前平均HVPG分别为(16.34±3.23)mmHg和(17.67±4.23)mmHg,差异无统计学意义(P=0.190)。中位随访时间为29.5个月,其中TIPS组为28个月,内镜组为30个月。
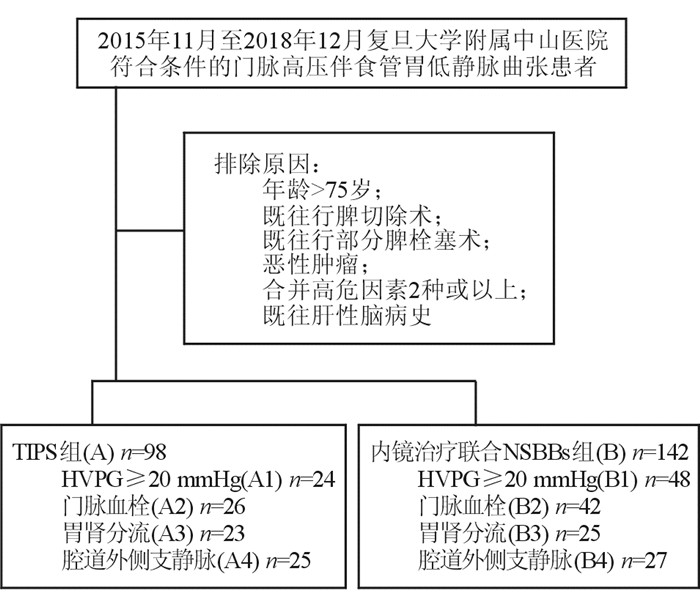
|
| 图 1 患者筛选及分组过程 TIPS:经颈静脉肝内门体分流术;NSBBs:非选择性β受体阻滞剂;HVPG:肝静脉压力梯度。 |
| 指标 | TIPS组(n=98) | 内镜组(n=142) |
| 年龄/岁 | 58.3±2.67 | 52.3±9.43* |
| 性别(男/女) n | 58/40 | 89/53 |
| 病因(HBV/其他) n | 68/30 | 104/38 |
| 血小板×109/L-1 | 70.4±43.5 | 67.8±47.3 |
| 总胆红素/(μmol·L-1) | 17.8±7.7 | 19.4±8.7 |
| 白蛋白/(g·L-1) | 36.7±4.6 | 35.6±5.2 |
| ALT/(U·L-1) | 19.2±12.7 | 24.5±12.2 |
| AST/(U·L-1) | 27.6±10.8 | 32.5±26.7 |
| 血肌酐/ (μmol·L-1) | 68.4±18.7 | 69.8±19.6 |
| PT/s | 14.2±1.5 | 14.5±1.4 |
| INR | 1.22±1.1 | 1.24±0.10 |
| Child-Pugh评分 | 6.3±3.4 | 6.5±1.2 |
| Child等级(A/B)n | 57/41 | 84/58 |
| MELD评分 | 5.2±3.7 | 5.4±4.6 |
| TIPS:经颈静脉肝内门体分流术;ALT:谷氨酸转氨酶;AST:天冬氨酸转氨酶;PT:凝血酶原时间;INR:国际标准化比值;MELD:终末期肝病模型;*P < 0.05与TIPS组相比。 | ||
| 指标 | TIPS组(n=98) | 内镜组(n=142) | |||||||
| HVPG (n=24) |
PVT (n=26) |
GRS (n=23) |
ep-GVs (n=25) |
HVPG (n=48) |
PVT (n=42) |
GRS (n=25) |
ep-GVs (n=27) |
||
| 年龄/岁 | 59.2±7.4 | 54.9±9.7 | 59.1±9.6 | 55.7±7.4 | 53.4±11.5 | 56.2±12.5 | 55.8±11.7 | 52.1±12.2 | |
| 性别(男/女) n | 15/9 | 14/12 | 14/9 | 15/10 | 30/18 | 26/16 | 16/9 | 17/10 | |
| 病因(HBV/其他) n | 18/6 | 19/7 | 15/8 | 16/9 | 37/11 | 30/12 | 19/6 | 18/9 | |
| 血小板×109/L-1 | 73.2±30.1 | 84.6±71.9 | 68.5±24.6 | 89.4±104 | 68.5±30.6 | 68.4±64.2 | 71.2±29.8 | 67.2±11.4 | |
| 总胆红素/ (μmol·L-1) | 16.8±4.2 | 16.4±7.2 | 21.3±6.8 | 23.6±9.3 | 22.4±8.6 | 18.3±10.2 | 22.4±8.6 | 25.8±9.5 | |
| 白蛋白/(g·L-1) | 36.8±5.8 | 36.8±4.2 | 37.4±4.2 | 38.5±3.6 | 35.6±7.2 | 38.3±5.4 | 36.6±5.4 | 38.2±4.2 | |
| ALT/(U·L-1) | 23.6±15.1 | 20.5±9.27 | 24.2±7.6 | 24.2±12.5 | 24.2±14.7 | 22.3±11.5 | 26.9±12.7 | 19.2±2.3 | |
| AST/(U·L-1) | 28.4±12.5 | 28.2±12.4 | 25.7±10.1 | 38.6±10.6 | 32.8±15.4 | 29.5±12.5 | 27.4±10.4 | 29.7±9.6 | |
| 血肌酐/ (μmol·L-1) | 64.8±20.9 | 77.6±21.3 | 64.6±16.8 | 58.37±6.4 | 67.8±16.5 | 75.4±15.4 | 60.9±15.2 | 62.6±2.3 | |
| PT/s | 15.0±1.6 | 13.4±1.34 | 14.2±1.84 | 13.9±1.4 | 14.6±1.5 | 14.2±1.23 | 14.2±1.18 | 14.8±1.9 | |
| INR | 1.33±0.75 | 1.32±0.24 | 1.34±0.56 | 1.28±0.27 | 1.28±0.65 | 1.28±0.36 | 1.29±0.13 | 1.31±0.29 | |
| Child-Pugh评分 | 6.5±1.25 | 6.17±1.14 | 6.44±1.35 | 6.36±1.57 | 6.4±2.34 | 6.74±1.33 | 6.22±1.08 | 6.21±1.29 | |
| Child等级(A/B) n | 15/9 | 15/11 | 13/10 | 14/11 | 28/20 | 25/17 | 14/11 | 17/10 | |
| MELD评分 | 4.52±2.35 | 5.43±3.9 | 3.42±2.71 | 5.36±2.2 | 5.14±5.58 | 5.23±4.63 | 4.41±4.67 | 6.20±3.40 | |
| TIPS:经颈静脉肝内门体分流术;HVPG:肝静脉压力梯度;PVT: 门静脉血栓; GRS:胃肾分流;ep-GVs:腔外侧支静脉;ALT:谷氨酸转氨酶;AST:天冬氨酸转氨酶;PT:凝血酶原时间;INR:国际标准化比值;MELD:终末期肝病模型。 | |||||||||
TIPS组患者手术成功率为100%,平均门体压力梯度由术前(20.8±5.36)mmHg降至(10.6±3.57)mmHg(P < 0.001)。76例患者在术中接受同步曲张静脉栓塞治疗。内镜组116例(81.7%)患者在接受了平均(2.6±1.37)次(1~6次)和平均(6.9±2.14)个月(3~14个月)的内镜下套扎和硬化剂注射治疗后,静脉曲张基本消失。8例患者因大出血死亡,9例行挽救性TIPS治疗,2例行肝移植。内镜组患者均接受普萘洛尔治疗,平均剂量(63.2±33.6) mg/d。
2.3 不良事件发生情况及处理结果(表 3)显示:随访过程中,2组共有53例(22.1%)患者发生72次静脉曲张再出血,其中TIPS组7例(7.1%)患者发生8次再出血,内镜组46例(32.4%)发生64次再出血。TIPS组7例患者均经DSA发现支架狭窄,行支架狭窄部位球囊扩张和支架再植入。内镜组29例患者接受内镜下止血治疗,9例患者行挽救性TIPS治疗,余8例因静脉曲张大出血死亡。随访期间,2组共有32例(13.3%)患者发生至少1次显性肝性脑病,其中TIPS组17例(17.3%)、内镜组15例(10.6%)。TIPS组2例患者发生严重肝性脑病,除其中1例死于严重肝性脑病所致电解质紊乱外,余31例患者肝性脑病均得到有效控制。
| n(%) | |||||||||||||||||||||||||||||
| 组别 | 静脉曲张再出血 | 肝性脑病 | 死亡 | ||||||||||||||||||||||||||
| TIPS组(n=98) | 7(7.1) | 17(17.3) | 7(7.1) | ||||||||||||||||||||||||||
| HVPG(n=24) | 2(8.3) | 5(20.8) | 2(8.3) | ||||||||||||||||||||||||||
| PVT(n=26) | 2(7.7) | 4(15.4) | 1(3.8) | ||||||||||||||||||||||||||
| GRS(n=23) | 1(4.3) | 4(17.4) | 2(8.7) | ||||||||||||||||||||||||||
| ep-GVs(n=25) | 2(8.0) | 4(16.0) | 2(8.0) | ||||||||||||||||||||||||||
| 内镜组(n=142) | 46(32.4) | 15(10.6) | 12(8.5) | ||||||||||||||||||||||||||
| HVPG(n=48) | 16(33.3) | 5(10.4) | 4(8.3) | ||||||||||||||||||||||||||
| PVT(n=42) | 12(28.5) | 4(2.9) | 3(7.1) | ||||||||||||||||||||||||||
| GRS(n=25) | 8(3.2) | 3(12.0) | 3(12.0) | ||||||||||||||||||||||||||
| ep-GVs(n=27) | 10(37.0) | 3(11.1) | 2(7.4) | ||||||||||||||||||||||||||
| TIPS:经颈静脉肝内门体分流术;HVPG:肝静脉压力梯度;PVT: 门静脉血栓; GRS:胃肾分流;ep-GVs:腔外侧支静脉。 | |||||||||||||||||||||||||||||
2组共19例(7.9%)患者在随访中死亡,其中TIPS组7例(7.1%)、内镜组12例(8.5%)。除内镜组8例死于严重静脉曲张出血、TIPS组1例死于严重肝性脑病外,另10例死于肝功能衰竭(TIPS组6例,内镜组4例)。结果(图 2)表明:TIPS组2年无再出血累计生存率明显高于内镜组(94% vs 70%, P < 0.001);2组2年无肝性脑病累计生存率差异无统计学意义(83% vs 91%,P=0.138);2组2年累计总生存率差异无统计学意义(92% vs 92%, P=0.647)。
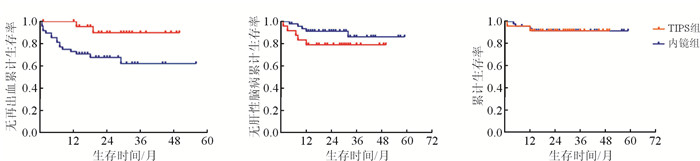
|
| 图 2 TIPS组与内镜组患者的生存情况对比 |
Cox回归分析(表 4)表明:治疗方式以及病因(HBV感染)为高危患者静脉曲张再出血的独立预测因素(P < 0.05);白蛋白为高危患者肝性脑病发生的独立预测因素(P < 0.05);总胆红素、白蛋白及MELD评分是患者总生存期的独立预测因素(P < 0.05)。
| 指标 | 单因素 | 多因素 | |||
| HR(95%CI) | P值 | HR(95%CI) | P值 | ||
| 静脉曲张再出血 | |||||
| 治疗方法 | 0.167(0.063~0.673) | 0.013 | 0.178(0.064~0.662) | 0.005 | |
| 病因(乙型肝炎病毒感染/其他) | 2.084(0.989~4.326) | 0.058 | 2.48(1.35~5.71) | 0.023 | |
| Child-Pugh评级 | 1.321(0.972~1.652) | 0.091 | |||
| 肝性脑病 | |||||
| 血小板 | 1.012(0.923~1.021) | 0.071 | |||
| 白蛋白 | 1.142(1.015~1.235) | 0.042 | 1.125(1.004~1.228) | 0.042 | |
| 总生存期 | |||||
| 总胆红素 | 1.521(1.016~1.721) | 0.028 | 1.281(1.162~1.528) | 0.023 | |
| 白蛋白 | 0.897(0.784~0.976) | 0.026 | 0.871(0.783~0.921) | 0.015 | |
| MELD评分 | 1.252(1.036~1.563) | 0.031 | 1.372(1.265~1.790) | 0.028 | |
| MELD:终末期肝病模型。 | |||||
TIPS组与内镜组HVPG亚组患者术前平均HVPG分别为(22.42±3.37)mmHg、(22.29±2.63) mmHg,差异无统计学意义(P=0.359)。结果(图 3A)显示:TIPS组HVPG亚组2年无再出血累计生存率明显高于内镜组HVPG亚组(89% vs 68%, P=0.018),2年无肝性脑病累计生存率(79% vs 91%, P=0.223)和2年累计总生存率差异无统计学意义(92% vs 91%, P=0.997)。
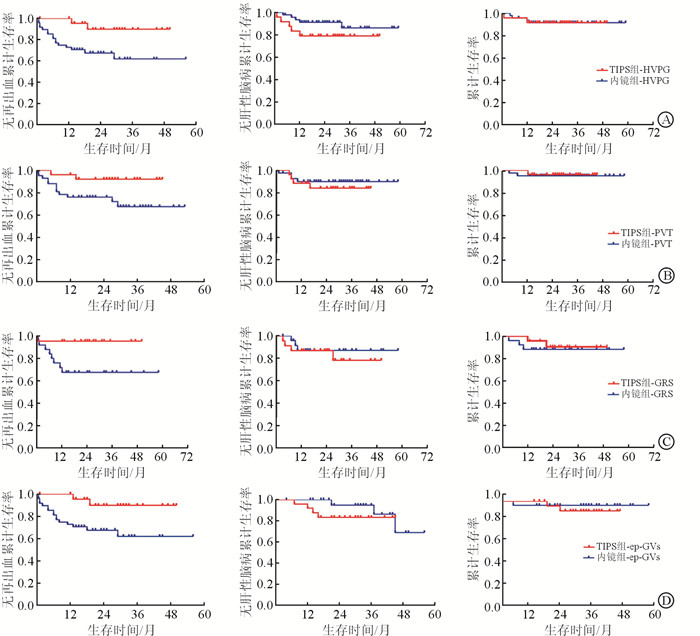
|
| 图 3 各亚组患者生存情况对比 A:HVPG亚组;B:PVT亚组;C:GRS亚组;D:ep-GVs亚组。 |
TIPS组与内镜组PVT亚组术前平均HVPG分别为(15.53±2.56)mmHg与(15.02±1.88)mmHg,差异无统计学意义(P=0.121)。结果(图 3B)显示:TIPS组PVT亚组2年无再出血累计生存率高于内镜组PVT亚组(92% vs 76%,P=0.041);两对应亚组2年无肝性脑病累计生存率(84% vs 90%,P=0.528)和2年累计生存率(96% vs 93%,P=0.563)差异无统计学意义。
2.6.3 GRS亚组TIPS组与内镜组GRS亚组术前平均HVPG分别为(15.39±2.44) mmHg、(15.20±2.38) mmHg,差异无统计学意义(P=0.960)。结果(图 3C)显示:TIPS组GRS亚组2年无再出血累计生存率明显高于内镜组GRS亚组(96% vs 67%, P=0.017);两对应亚组2年无肝性脑病累计生存率(87% vs 87%,P=0.624)和2年累计生存率(90% vs 88%,P=0.638)差异无统计学意义。
2.6.4 ep-GVs亚组TIPS组与内镜组ep-GVs亚组术前平均HVPG分别为(14.48±2.06) mmHg、(14.74±1.93)mmHg,差异无统计学意义(P=0.757)。结果(图 3D)显示:TIPS组ep-GVs亚组2年无再出血累计生存率明显低于内镜组ep-GVs亚组(92% vs 67%,P=0.011);两对应亚组2年无肝性脑病累计生存率(84% vs 95%,P=0.411)和2年累计生存率(91% vs 93%,P=0.989)差异无统计学意义。
3 讨论TIPS一般被用于内镜治疗失败的患者。近年来研究[19-21]表明,TIPS应用覆膜支架与内镜治疗联合NSBBs相比,可更有效降低静脉曲张再出血率,但2种方法对患者生存率和肝性脑病发生率差异无统计学意义。对于合并Child-Pugh C级或持续出血的B级急性食管胃底静脉曲张出血患者,早期TIPS较内镜治疗联合NSBBs治疗可以降低再出血率、提高生存率[6]。本研究中,TIPS组再出血率低于内镜组,同时不增加肝性脑病发生,但是2组生存率差异无统计学意义;亚组分析得到相似结论。
HVPG作为评估门静脉压力的金标准,在门静脉高压的诊断与分型、评估进展以及指导治疗方面发挥重要作用[22]。HVPG与食管胃底静脉曲张密切相关,当HVPG≥12 mmHg时,容易发生食管胃底静脉曲张;当HVPG≥20 mmHg时,容易发生早期再出血或不可控制大出血。既往研究[23]表明,对于HVPG≥20 mmHg的急性静脉曲张出血患者,早期应用TIPS可以降低治疗失败率和死亡率。本研究中,虽然2组HVPG亚组生存率差异无统计学意义,但TIPS组HVPG亚组无再出血率高于内镜组HVPG亚组。
PVT可以加重门静脉压力,增加静脉曲张破裂出血的风险,还会降低门静脉血流灌注量,损伤肝脏功能。对于PVT合并失代偿期肝硬化患者,尤其是既往有静脉曲张出血史的患者,内科医师进行抗凝治疗时应谨慎[24]。TIPS可以有效开通门静脉血流,降低门静脉压力,增加肝脏血流灌注。既往研究[19, 25]发现,与对于合并PVT的食管胃底静脉曲张患者,TIPS术后再出血率低于内镜联合药物治疗,同时肝性脑病未增加,本研究结果与之一致,区别在于本研究应用了最新的PTFE覆膜支架。
胃肾分流在肝硬化患者中占15%~20%[26],在胃底静脉曲张患者中占65%~85%[10-11]。当胃底静脉曲张合并胃肾分流时,内镜治疗存在异位栓塞风险,如肺动脉栓塞、卒中、多器官衰竭等[27]。此外,治疗后胃肾分流并没有消失,仍存在复发风险。既往研究[28]发现,胃肾分流可以增加肝性脑病发生,损害肝功能。球囊导管逆行性栓塞术对胃底静脉曲张合并胃肾分流的效果较好[29]。而本研究提示,对于该类患者,TIPS可以降低门静脉压力,预防再出血,同时可以同步栓塞分流道,阻塞异常分流道。
有研究[30]显示,在静脉曲张套扎治疗时,腔外侧支血管的直径大小与再出血密切相关。另一项研究[15]也发现,腔外侧支血管的存在会增加内镜治疗后静脉曲张再出血。本研究中TIPS ep-GVs亚组术后无再出血率低于内镜组,与内镜治疗仅能处理腔内静脉曲张,不能处理腔外静脉曲张有关,而TIPS可以同步栓塞腔内外血管。
本研究中,TIPS并没有增加术后HE发生率,且2组患者累计生存率差异无统计学意义,提示存在影响生存的其他因素。Cox回归分析表明,总胆红素、白蛋白和MELD评分是该类患者生存的独立影响因素。此外,内镜组有9例患者因为持续性再出血行挽救性TIPS治疗,这也可能影响TIPS改善患者生存的优势。
综上所述,预防合并HVPG ≥20 mmHg、PVT、胃肾分流或腔外侧支静脉的门静脉高压静脉曲张再出血,TIPS应用Viatorr覆膜支架预防效果优于内镜治疗联合NSBBs,可以有效降低再出血率,同时并不增加HE发病率,值得临床推广。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
GARCIA-TSAO G, ABRALDES J G, BERZIGOTTI A, et al. Portal hypertensive bleeding in cirrhosis: risk stratification, diagnosis, and management: 2016 practice guidance by the American Association for the Study of Liver Diseases[J]. Hepatology, 2017, 65(1): 310-335.
[DOI]
|
| [2] |
DE FRANCHIS R. Expanding consensus in portal hypertension: report of the Baveno Ⅵ Consensus Workshop: stratifying risk and individualizing care for portal hypertension[J]. J Hepatol, 2015, 63(3): 743-752.
[DOI]
|
| [3] |
European Association for the Study of the Liver. EASL Clinical practice guidelines for the management of patients with decompensated cirrhosis[J]. J Hepatol, 2018, 69(2): 406-460.
[DOI]
|
| [4] |
中华医学会外科学分会脾及门静脉高压外科学组. 肝硬化门静脉高压症食管、胃底静脉曲张破裂出血诊治专家共识(2019版)[J]. 中华消化外科杂志, 2019, 18(12): 1087-1093. Chinese Society of Spleen and Portal Hypertension Surgery, Chinese Society of Surgery, Chinese Medical Association. Expert consensus on diagnosis and treatment of esophagogastric variceal bleeding in cirrhotic portal hypertension (2019 edition)[J]. Chinese Journal of Digestive Surgery, 2019, 18(12): 1087-1093. [DOI] |
| [5] |
BOSCH J, GARCÍA-PAGÁN J C. Prevention of variceal rebleeding[J]. Lancet, 2003, 361(9361): 952-954.
[DOI]
|
| [6] |
GARCÍA-PAGÁN J C, CACA K, BUREAU C, et al. Early use of TIPS in patients with cirrhosis and variceal bleeding[J]. N Engl J Med, 2010, 362(25): 2370-2379.
[DOI]
|
| [7] |
SUK K T. Hepatic venous pressure gradient: clinical use in chronic liver disease[J]. Clin Mol Hepatol, 2014, 20(1): 6-14.
[DOI]
|
| [8] |
MOITINHO E, ESCORSELL A, BANDI J C, et al. Prognostic value of early measurements of portal pressure in acute variceal bleeding[J]. Gastroenterology, 1999, 117(3): 626-631.
[DOI]
|
| [9] |
QI X, HAN G, FAN D. Management of portal vein thrombosis in liver cirrhosis[J]. Nat Rev Gastroenterol Hepatol, 2014, 11(7): 435-446.
[DOI]
|
| [10] |
WATANABE K, KIMURA K, MATSUTANI S, et al. Portal hemodynamics in patients with gastric varices. A study in 230 patients with esophageal and/or gastric varices using portal vein catheterization[J]. Gastroenterology, 1988, 95(2): 434-440.
[DOI]
|
| [11] |
MATSUMOTO A, HAMAMOTO N, NOMURA T, et al. Balloon-occluded retrograde transvenous obliteration of high risk gastric fundal varices[J]. Am J Gastroenterol, 1999, 94(3): 643-649.
[DOI]
|
| [12] |
GARCÍA-PAGÁN J C, BARRUFET M, CARDENAS A, et al. Management of gastric varices[J]. Clin Gastroenterol Hepatol, 2014, 12(6): 919-928.
[DOI]
|
| [13] |
ASGE Technology Committee; BHAT Y M, BANERJEE S, BARTH B A, et al. Tissue adhesives: cyanoacrylate glue and fibrin sealant[J]. Gastrointest Endosc, 2013, 78(2): 209-215.
[DOI]
|
| [14] |
KAHLOON A, CHALASANI N, DEWITT J, et al. Endoscopic therapy with 2-octyl-cyanoacrylate for the treatment of gastric varices[J]. Dig Dis Sci, 2014, 59(9): 2178-2183.
[DOI]
|
| [15] |
TSENG Y, MA L, LUO T, et al. Patient response to endoscopic therapy for gastroesophageal varices based on endoscopic ultrasound findings[J]. Gut Liver, 2018, 12(5): 562-570.
[DOI]
|
| [16] |
DARWISH M S, LUONG T K, PATTYNAMA P M, et al. Long-term outcome of a covered vs. uncovered transjugular intrahepatic portosystemic shunt in Budd-Chiari syndrome[J]. Liver Int, 2008, 28(2): 249-256.
[DOI]
|
| [17] |
VILSTRUP H, AMODIO P, BAJAJ J, et al. Hepatic encephalopathy in chronic liver disease: 2014 Practice Guideline by the American Association for the Study of Liver Diseases and the European Association for the Study of the Liver[J]. Hepatology, 2014, 60(2): 715-735.
[DOI]
|
| [18] |
FRANCHIS R. Revising consensus in portal hypertension: report of the Baveno Ⅴ Consensus Workshop on Methodology of Diagnosis and Therapy in Portal Hypertension[J]. J Hepatol, 2010, 53(4): 762-768.
[DOI]
|
| [19] |
LV Y, QI X S, HE C Y, et al. Covered TIPS versus endoscopic band ligation plus propranolol for the prevention of variceal rebleeding in cirrhotic patients with portal vein thrombosis: a randomised controlled trial[J]. Gut, 2018, 67(12): 2156-2168.
[DOI]
|
| [20] |
HOLSTER I L, TJWA E T, MOELKER A, et al. Covered transjugular intrahepatic portosystemic shunt versus endoscopic therapy + beta-blocker for prevention of variceal rebleeding[J]. Hepatology, 2016, 63(2): 581-589.
[DOI]
|
| [21] |
SAUERBRUCH T, MENGEL M, DOLLINGER M, et al. Prevention of rebleeding from esophageal varices in patients with cirrhosis receiving small-diameter stents versus hemodynamically controlled medical therapy[J]. Gastroenterology, 2015, 149(3): 660-668.
[DOI]
|
| [22] |
BOSCH J, ABRALDES J G, BERZIGOTTI A, et al. The clinical use of HVPG measurements in chronic liver disease[J]. Nat Rev Gastroenterol Hepatol, 2009, 6(10): 573-582.
[DOI]
|
| [23] |
MONESCILLO A, MARTÍNEZ-LAGARES F, RUIZ-DEL-ARBOL L, et al. Influence of portal hypertension and its early decompression by TIPS placement on the outcome of variceal bleeding[J]. Hepatology, 2004, 40(4): 793-801.
[DOI]
|
| [24] |
CAMPBELL S, LACHLAN N J. Anticoagulation for cirrhotic portal vein thrombosis: bold, brave, and possibly beneficial[J]. Clin Gastroenterol Hepatol, 2012, 10(7): 784-785.
[DOI]
|
| [25] |
LUO X F, WANG Z, TSAUO J, et al. Advanced cirrhosis combined with portal vein thrombosis: a randomized trial of TIPS versus endoscopic band ligation plus propranolol for the prevention of recurrent esophageal variceal bleeding[J]. Radiology, 2015, 276(1): 286-293.
[DOI]
|
| [26] |
WU Q, SHEN L J, CHU J D, et al. Characterization of uncommon portosystemic collateral circulations in patients with hepatic cirrhosis[J]. Oncol Lett, 2015, 9(1): 347-350.
[DOI]
|
| [27] |
QI X, QI X, ZHANG Y, et al. Prevalence and clinical characteristics of spontaneous splenorenal shunt in liver cirrhosis: a retrospective observational study based on contrast-enhanced computed tomography (CT) and magnetic resonance imaging (MRI) scans[J]. Med Sci Monit, 2017, 23: 2527-2534.
[DOI]
|
| [28] |
IRISAWA A, SAITO A, OBARA K, et al. Endoscopic recurrence of esophageal varices is associated with the specific EUS abnormalities: severe periesophageal collateral veins and large perforating veins[J]. Gastrointest Endosc, 2001, 53(1): 77-84.
[DOI]
|
| [29] |
金倩雯, 姚群燕, 罗剑钧, 等. 球囊导管逆行性静脉栓塞术治疗肝硬化胃底静脉曲张1例报告并文献复习[J]. 中国临床医学, 2018, 25(5): 835-839. JIN Q W, YAO Q Y, LUO J J, et al. Balloon-occluded retrograde transvenous obliteration for the mangenment of gastric fundal varices in cirrhosis: case report and literature review[J]. Chinese Journal of Clinical Medicine, 2018, 25(5): 835-839. [URI] |
| [30] |
CARNEIRO F O, RETES F A, MATUGUMA S E, et al. Role of EUS evaluation after endoscopic eradication of esophageal varices with band ligation[J]. Gastrointest Endosc, 2016, 84(3): 400-407.
[DOI]
|
 2021, Vol. 28
2021, Vol. 28


