随着宫颈癌筛查的普及和阴道镜的广泛应用,阴道上皮内瘤变(vaginal intraepithelial neoplasia,VaIN)的检出率逐渐上升。2013年至2015年VaIN占下生殖道上皮内瘤变的比例分别为8.09%(372/4 598)、12.45%(717/5 760)、13.08%(834/6 374)[1],引起越来越多的临床关注。目前认为高危型人乳头瘤病毒(high risk human papillomavirus,HR-HPV)持续感染为病变发生、进展及复发的主要原因。但并非所有HR-HPV感染均会发生持续感染,继而导致病变的发生,提示尚有其他未知因素作用其中。
既往研究[2]发现,阴道微生态失衡为HR-HPV持续感染的高危因素。绝经后女性由于卵巢功能衰退, 雌激素水平降低, 乳杆菌含量减少,阴道微生态平衡状态被打破,更易发生HR-HPV的持续感染。本研究拟收集、分析复旦大学附属妇产科医院经阴道镜定位活检或组织病理学检查确诊为VaIN的绝经后女性和宫颈癌筛查双阴性的绝经后女性的相关临床资料,比较VaIN与正常人群阴道微生态的差异,探讨阴道微生态与HR-HPV持续感染及VaIN的关系,为HR-HPV感染的绝经后女性VaIN的防治提供临床依据。
1 资料与方法 1.1 一般资料选择2020年5月至2020年8月于复旦大学附属妇产科医院宫颈疾病诊疗中心就诊的绝经后女性,因各种指征行阴道镜检查,并经活组织检查诊断为VaIN的160例患者作为病变组。根据病变级别进一步分为低度上皮内病变(low-grade squmous interaepithelial lesion, LSIL)组(n=125)及高度上皮内病变(high-grade squmous interaepithelial lesion, HSIL)组(n=35)。另选同期于本院预防保健科体检的HPV阴性且液基细胞检测(liquid-based cytologic test,LCT)阴性的健康绝经后女性志愿者50例为对照组,分析组间临床资料差异,并进一步比较组间阴道微生态的差异。纳入标准:取样前1周未使用抗生素;无阴道冲洗、上药史;24 h内无性生活。本研究已获得复旦大学附属妇产科医院医学伦理委员会批准(2019-144)。
1.2 检测方法 1.2.1 阴道微生态检测用3支干棉签在阴道侧壁上1/3取少量阴道分泌物。1支涂抹于清洁载玻片后, 镜下进行分泌物清洁度评分,检查是否存在滴虫、菌丝、线索细胞等;1支经革兰染色后行Nugent评分及菌群密集度、多样性评分;1支用于阴道微生物功能及炎症反应指标检测,试剂盒购自江苏硕世生物科技股份有限公司,经bPR-2014A阴道炎自动检测工作站分析结果。
1.2.2 LCT检测用扩阴器充分暴露宫颈/阴道残端,清洁表面分泌物后,采用特定刷头按顺时针刷取标本,放入装有样本保存液的样本管中,旋紧瓶盖送检。根据Bethesda细胞学分类法(the Bethesda system, TBS)将LCT结果分为无上皮内病变及恶性病变细胞(no intraepithelial lesion or malignant cells, NILM)、非典型鳞状上皮细胞-不能明确意义(atypical squamous cells of undetermined significance, ASCUS)、LSIL、非典型鳞状上皮细胞-不除外高度上皮内病变(atypical squamous cells: cannot exclude high-grade squamous intraepithelial lesion, ASC-H)、HSIL。
1.2.3 HR-HPV检测用扩阴器充分暴露宫颈/阴道残端,清洁表面分泌物后,采用特定刷头按顺时针刷取标本,送病理科,采用多重荧光PCR分管分型检测。
1.2.4 阴道镜检查和病理组织学检查患者取膀胱截石位,采用莱斯康公司型号D-10625阴道镜, 由专职医生全方位检查外阴、阴道以及宫颈,依次进行醋白试验和碘染色, 对可疑区域进行活检,送病理组织学检查。由具有高级职称的病理科医师进行诊断。异常检验结果按世界卫生组织(WHO)第4版《女性生殖器官肿瘤分类》二级分类法分为LSIL及HSIL。
1.3 诊断标准 1.3.1 阴道微生态功能学指标过氧化氢 < 2 μmol/L时为阳性,白细胞酯酶≥9 U/L时为阳性,唾液酸苷酶≥7 U/mL时为阳性,β-葡萄糖醛酸酶≥0.5 g/L为阳性,乙酰氨基葡萄糖苷酶≥0.1 U/mL为阳性。
1.3.2 正常阴道微生态菌群密集度Ⅱ~Ⅲ级,菌群多样性Ⅱ~Ⅲ级,优势菌为革兰阳性大杆菌,清洁度Ⅰ度,分泌物中未见滴虫、孢子及菌丝等,乳杆菌功能正常(过氧化氢阴性、白细胞酯酶阴性),pH值:3.8~4.5。
1.3.3 阴道炎诊断阴道分泌物中测及阴道毛滴虫、菌丝及孢子诊断为相应阴道炎。
1.3.4 HR-HPV感染检测HPV 16、HPV 18、HPV 31、HPV 33、HPV 35、HPV 39、HPV 45、HPV 51、HPV 52、HPV 56、HPV 58、HPV 59、HPV 66、HPV 68是否为阳性。
1.4 统计学处理采用Graphpad Prism 8统计学软件进行分析, 计量资料以x±s表示, 比较采用t检验;计数资料以n(%)表示, 比较采用χ2检验。利用logistic回归分析计算OR值及95%CI,描述相关危险因素与VaIN发生的风险,检验水准(α)为0.05。
2 结果 2.1 一般资料分析结果(表 1)显示:病变组平均年龄(58.17±5.39)岁,对照组平均年龄(56.18±4.60)岁。病变组中行全子宫切除患者占40%(64/160),对照组中行全子宫切除患者占16%(8/50)。病变组中LSIL患者125例,平均年龄(58.35±5.39)岁,HSIL患者35例,平均年龄为(57.51±5.42)岁。LSIL中行全子宫切除患者占32%(40/125),HSIL中行全子宫切除患者占68.57%(24/35), 差异有统计学意义(P < 0.001)。此外,LSIL组中既往接受放射治疗者占0.8%(1/125),HSIL组中既往接受放射治疗者占8.57%(3/35),差异有统计学差异(P=0.009)。两病变亚组其余临床特征差异无统计学意义。
| n(%) | |||||||||||||||||||||||||||||
| 指标 | LSIL组(n=125) | HSIL组(n=35) | t/ χ2值 | P值 | |||||||||||||||||||||||||
| 年龄/岁 | 58.35±5.39 | 57.51±5.42 | 0.812 | 0.921 | |||||||||||||||||||||||||
| 全子宫切除 | 15.240 | < 0.001 | |||||||||||||||||||||||||||
| 是 | 40(32.00) | 24(68.57) | |||||||||||||||||||||||||||
| 否 | 85(68.00) | 11(31.43) | |||||||||||||||||||||||||||
| 全子宫切除原因 | |||||||||||||||||||||||||||||
| 良性疾病 | 17(13.60) | 3(8.57) | 11.123 | 0.012 | |||||||||||||||||||||||||
| 宫颈HSIL | 17(13.60) | 17(48.57) | 4.836 | 0.028 | |||||||||||||||||||||||||
| 宫颈癌 | 5(4.00) | 4(3.20) | 0.009 | 0.926 | |||||||||||||||||||||||||
| 内膜癌 | 1(0.80) | 0(0.00) | — | > 0.999 | |||||||||||||||||||||||||
| 第1次性行为小于21岁 | 0.172 | 0.678 | |||||||||||||||||||||||||||
| 是 | 44(35.20) | 11(31.43) | |||||||||||||||||||||||||||
| 否 | 81(64.80) | 24(68.57) | |||||||||||||||||||||||||||
| 性伴侣3个及以上 | 0.222 | 0.637 | |||||||||||||||||||||||||||
| 是 | 11(8.80) | 4(11.43) | |||||||||||||||||||||||||||
| 否 | 114(91.20) | 31(88.57) | |||||||||||||||||||||||||||
| 分娩方式 | 0.572 | 0.449 | |||||||||||||||||||||||||||
| 顺产 | 110(88.00) | 33(94.29) | |||||||||||||||||||||||||||
| 剖宫产 | 15(12.00) | 2(5.71) | |||||||||||||||||||||||||||
| 高血压 | 0.650 | 0.420 | |||||||||||||||||||||||||||
| 是 | 18(14.40) | 7(20.00) | |||||||||||||||||||||||||||
| 否 | 107(85.60) | 28(80.00) | |||||||||||||||||||||||||||
| 糖尿病 | 0.151 | 0.697 | |||||||||||||||||||||||||||
| 是 | 8(6.40) | 1(2.86) | |||||||||||||||||||||||||||
| 否 | 117(93.60) | 34(97.14) | |||||||||||||||||||||||||||
| 自身免疫性疾病 | 0.647 | 0.421 | |||||||||||||||||||||||||||
| 是 | 1(0.80) | 0(0.00) | |||||||||||||||||||||||||||
| 否 | 124(99.20) | 35(100.00) | |||||||||||||||||||||||||||
| 放疗史 | 6.775 | 0.009 | |||||||||||||||||||||||||||
| 是 | 1(0.80) | 3(8.57) | |||||||||||||||||||||||||||
| 否 | 124(99.20) | 32(91.43) | |||||||||||||||||||||||||||
结果(图 1)显示:病变组患者中HR-HPV感染率为63.1%(101/160);LSIL组中HR-HPV感染率为57.6%(72/125),HSIL组中HR-HPV感染率为82.86%(29/35),差异有统计学意义(P=0.006)。感染者中最常见HPV 16,占25.6%;其次为HPV 52,占10%。
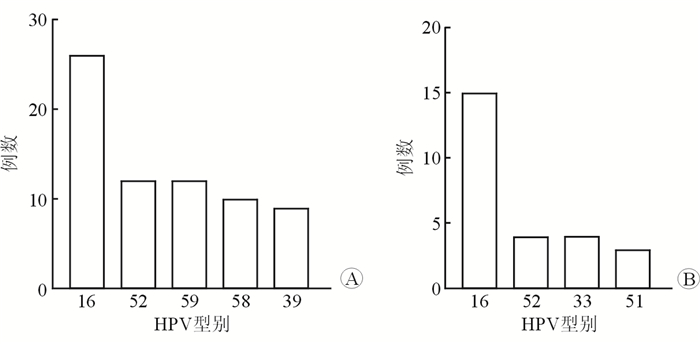
|
| 图 1 LSIL组(A)和HSIL组(B)中HR-HPV类型分布 |
结果(表 2)显示:LSIL及HSIL组中单一HPV感染率均高于多重HPV感染。LSIL组HR-HPV阳性患者中单一型感染率为58.33%(42/72),HSIL组HR-HPV患者中单一型HR-HPV感染率为82.76%(24/29),差异有统计学意义(P=0.020)。
| n(%) | |||||||||||||||||||||||||||||
| 组别 | 单一HPV阳性 | 多重HPV阳性 | 合计 | ||||||||||||||||||||||||||
| LSIL组(n=125) | 42(41.58) | 30(29.70) | 72(71.29) | ||||||||||||||||||||||||||
| HSIL组(n=35) | 24(23.76) | 5(4.95) | 29(28.71) | ||||||||||||||||||||||||||
| 合计 | 66(65.35) | 35(34.65) | 101(100.00) | ||||||||||||||||||||||||||
210例绝经后女性阴道微生态普遍失调:过氧化氢阳性率(92.38%,194例)明显升高,177例(84.29%)伴多样性降低,117例(55.71%)密集度降低,优势菌以革兰阳性短杆菌为主(89.52%),Nugent评分异常者占47.14%。其中,滴虫性阴道炎8例(3.80%),霉菌性阴道炎19例(9.05%)。
2.4.1 LSIL组和HSIL组阴道微生态比较结果(表 3、表 4)显示:LSIL及HSIL组患者的阴道微生态形态学及功能学各指标差异均无统计学意义。
| n(%) | |||||||||||||||||||||||||||||
| 指标 | LSIL组(n=125) | HSIL组(n=35) | χ2值 | P值 | |||||||||||||||||||||||||
| 多样性降低 | 100(80.00) | 30(85.71) | 0.586 | 0.444 | |||||||||||||||||||||||||
| 密集度降低 | 69(55.20) | 19(54.29) | 0.009 | 0.923 | |||||||||||||||||||||||||
| 优势菌异常 | 115(92.00) | 33(94.29) | 0.206 | 0.650 | |||||||||||||||||||||||||
| Nugent评分异常 | 66(52.80) | 18(51.43) | 0.021 | 0.886 | |||||||||||||||||||||||||
| VVC | 12(9.60) | 1(2.86) | 1.665 | 0.197 | |||||||||||||||||||||||||
| VVC:外阴阴道假丝酵母菌病 | |||||||||||||||||||||||||||||
| n(%) | |||||||||||||||||||||||||||||
| 指标 | LSIL组(n=125) | HSIL组(n=35) | χ2值 | P值 | |||||||||||||||||||||||||
| 白细胞酯酶阳性 | 48(38.40) | 16(45.71) | 0.610 | 0.435 | |||||||||||||||||||||||||
| 乙酰氨基葡萄糖苷酶阳性 | 17(13.60) | 2(5.71) | 1.625 | 0.202 | |||||||||||||||||||||||||
| 过氧化氢阳性 | 115(92.00) | 34(97.14) | 1.130 | 0.288 | |||||||||||||||||||||||||
| 唾液酸苷酶阳性 | 3(2.40) | 0(0.00) | 0.857 | 0.355 | |||||||||||||||||||||||||
| β-葡萄糖醛酸酶阳性 | 0(0.00) | 0(0.00) | |||||||||||||||||||||||||||
| pH升高 | 42(33.60) | 13(37.14) | 0.152 | 0.697 | |||||||||||||||||||||||||
结果(表 5、表 6)显示:比较病变组、对照组的阴道微生态各指标发现,形态学指标中,多样性、优势菌及Nugent评分差异有统计学意义(P < 0.05)。功能学指标中,病变组较对照组白细胞酯酶阳性率升高、乙酰氨基葡萄糖苷酶阳性率降低,差异有统计学意义(P < 0.05)。
| n(%) | |||||||||||||||||||||||||||||
| 指标 | 病变组(n=160) | 对照组(n=50) | χ2值 | P值 | |||||||||||||||||||||||||
| 多样性降低 | 130(81.25) | 47(94.00) | 4.676 | 0.031 | |||||||||||||||||||||||||
| 密集度降低 | 88(55.00) | 29(58.00) | 0.139 | 0.709 | |||||||||||||||||||||||||
| 优势菌异常 | 148(92.50) | 40(80.00) | 6.347 | 0.012 | |||||||||||||||||||||||||
| Nugent评分异常 | 84(52.50) | 18(36.00) | 4.152 | 0.042 | |||||||||||||||||||||||||
| VVC | 13(8.13) | 6(12.00) | 0.695 | 0.404 | |||||||||||||||||||||||||
| VVC:外阴阴道假丝酵母菌病 | |||||||||||||||||||||||||||||
| n(%) | |||||||||||||||||||||||||||||
| 指标 | 病变组(n=160) | 对照组(n=50) | χ2值 | P值 | |||||||||||||||||||||||||
| 白细胞酯酶阳性 | 64(40.00) | 8(16.00) | 9.739 | 0.002 | |||||||||||||||||||||||||
| 乙酰氨基葡萄糖苷酶阳性 | 17(10.63) | 11(22.00) | 4.266 | 0.039 | |||||||||||||||||||||||||
| 过氧化氢阳性 | 149(93.13) | 45(90.00) | 0.529 | 0.467 | |||||||||||||||||||||||||
| 唾液酸苷酶阳性 | 3(1.88) | 1(2.00) | 0.003 | 0.955 | |||||||||||||||||||||||||
| β-葡萄糖醛酸酶阳性 | 0(0.00) | 0(0) | — | — | |||||||||||||||||||||||||
| pH升高 | 55(34.38) | 18(36.00) | 0.044 | 0.833 | |||||||||||||||||||||||||
结果(表 7、图 2)显示:白细胞酯酶阳性、多样性升高和优势菌异常与VaIN发生明显相关(P < 0.05), OR及95%CI分别为1.251(1.101 4~1.421 1)、0.791(0.672 5~0.931 1)和1.242(1.031 3~1.496 7)。优势菌异常及白细胞酯酶阳性为发病的危险因素,菌群多样性升高为发病的危险因素。
| 变量 | β | SE | P值 | OR | 95%CI |
| 白细胞酯酶阳性 | 0.224 | 0.065 | 0.000 7 | 1.251 | 1.101 4~1.421 1 |
| 多样性降低 | -0.234 | 0.083 | 0.005 1 | 0.791 | 0.672 5~0.931 1 |
| 优势菌异常 | 0.217 | 0.095 | 0.023 8 | 1.242 | 1.031 3~1.496 7 |
| Nugent评分异常 | 0.068 | 0.062 | 0.267 4 | 1.070 | 0.947 9~1.208 7 |
| VVC | -0.254 | 0.408 | 0.534 4 | 0.776 | 0.348 7~1.725 8 |
| VVC:外阴阴道假丝酵母菌病 | |||||
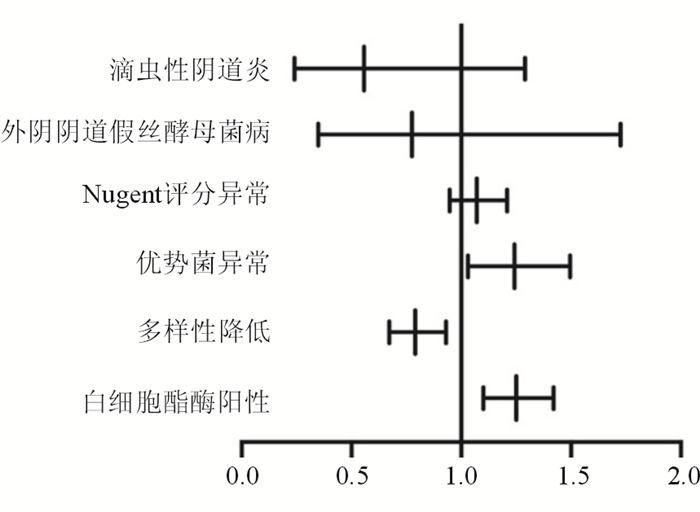
|
| 图 2 VaIN发病危险因素森林图 |
VaIN高危因素包括年龄、HR-HPV感染、既往因宫颈HSIL或宫颈癌行子宫切除术和放疗病史等[3],其中HR-HPV持续感染为VaIN发生发展的主要危险因素[4],以HPV 16最为常见[5]。80%HPV感染为一过性,在数月至2年内机体自然清除,仅少部分女性会持续感染,最终导致病变的发生发展[6],提示其他因素在此过程中发挥一定作用。近年来,随着流行病学及分子生物学的不断发展,阴道微生态与HR-HPV持续感染及鳞状上皮内病变发生的相关性开始受到关注。
阴道微生态由微生物菌群、阴道机械屏障、局部免疫系统及宿主内分泌功能共同组成,是一个动态并相对平衡的体系。阴道正常菌群在微生态平衡中发挥重要作用[7]。除此之外,年龄、月经、雌激素水平、吸烟、性交及卫生习惯等也起着重要作用[8]。绝经后女性体内雌激素水平降低,菌群结构改变,阴道上皮细胞变薄,细胞内糖原含量减少,乳酸生成减少,阴道内pH上升,打破微生态平衡,病原微生物易入侵,诱发炎症反应,导致病变的发生。
阴道微生物菌群的稳定性及组成在宿主固有免疫应答及对病原微生物的易感性中发挥重要作用。正常情况下,阴道微生态群中乳杆菌占主导地位。乳杆菌可分解阴道上皮糖原,产生大量乳酸维持阴道酸性环境[2, 9],产生过氧化氢及细菌素等[10]维持上皮屏障,抑制病原微生物入侵。测定过氧化氢浓度可间接反乳杆菌的功能。乳杆菌减少或活性下降,均可导致机会性感染概率上升。既往研究[11]表明,绝经后女性阴道内乳杆菌含量远低于正常育龄女性。周燕等[12]对4 630例绝经后妇女进行阴道微生态分析发现,绝经后女性乳杆菌数量及功能均降低,优势菌为乳杆菌患者占30.8%,过氧化氢阳性者占91.04%。本研究中对照组健康绝经后女性阴道优势菌为乳杆菌者占20%,阴道病变组中仅7.5%,两者相比差异有统计学意义(P=0.012),提示阴道上皮内病变发生与阴道内乳杆菌数目减少有关。过氧化氢阳性在病变组占93.13%,在对照组占90.00%,差异无统计学意义。这可能提示,较功能而言,乳杆菌数目增加在抑制发病中起到更重要的作用。
菌群多样性是机体健康与否的标志,阴道微生物菌群高度多样化常被认为与疾病状态相关[13]。既往研究[14]指出,绝经后女性阴道菌群多样性较育龄期女性显著下降,多样性升高为一种阴道微生态失衡状态,常与厌氧菌感染有关[15]。该类患者更易发生HPV的持续感染及宫颈上皮病变[16]。Brotman等[17]发现,菌群多样性升高伴乳杆菌数目减少的患者更易获得HPV感染甚至是持续性感染。Mitra等[16]将宫颈LSIL、宫颈HSIL、宫颈癌患者阴道微生态与正常健康女性阴道微生态相比发现,LSIL患者CST Ⅳ发生率较正常女性升高2倍,HSIL患者升高3倍,而浸润性宫颈癌患者则升高了4倍,且随着病变等级升高,阴道乳杆菌数目逐渐减少。北大第一医院妇产科的一项横截面研究[18]根据HPV、TCT及组织病理学结果将就诊患者分为对照组,HR-HPV阳性组及宫颈癌组。对比研究其阴道微生态发现,健康女性、HR-HPV阳性女性及宫颈癌女性阴道菌群多样性逐渐升高。本研究中病变组女性菌群多样性降低者占81.25%,显著少于对照组女性94.00%(P < 0.05),与既往研究一致,提示多样性增加在VaIN的发生发展中起到一定作用。
白细胞酯酶为白细胞的特异性酯酶,其阳性提示阴道黏膜受损。阴道分泌物中大量多核白细胞被破坏而释放该酶,表示存在炎症反应,与白细胞数量正相关,能间接反映病原微生物的增殖水平[19]。炎症反应是把双刃剑,其为宿主抵抗有害刺激免疫防御的第1步,可激活嗜中性粒细胞、单核-巨噬细胞等免疫细胞,使其迁移到炎症部位释放细胞因子等维持免疫反应,在机体免疫监视中发挥重要作用[20-21]。但若炎症持续,组织持续暴露于慢性炎症中将会诱导细胞群改变,损害细胞稳态,引发恶性转化[22]。Kemp等[23]对比发现,HPV持续感染女性炎症因子较健康女性明显增加。国内外研究[19]表明,宫颈鳞状上皮内病变与白细胞酯酶阳性显著相关。本研究发现病变组较对照组白细胞酯酶阳性率明显升高,差异有统计学意义(P < 0.05),进一步证实炎症反应在病变发生中发挥重要作用。
综上所述,众多因素参与VaIN的发生发展,阴道微生态的变化在其中起到关键作用,阴道微生态平衡破坏可能对VaIN发生有促进作用。本研究首次表明,特定的阴道微生态特点(如优势菌乳杆菌丰度降低、菌群多样性增加及机体炎症等)与VaIN发生密切相关。该发现能为未来临床诊疗提出新的思路,如:是否可以通过阴道微生态检测对该类患者进行分流;伴有该微生态特点的人群是否应接受更严格的阴道镜检查;改善该部分患者的阴道微生态是否能对抵抗HPV持续感染及改善相关病变的转归起到积极作用等。其具体分子机制则需要未来更多基础研究加以证实。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
丛青, 汪清, 高蜀君, 等. 2013-2015年阴道镜下阴道上皮内瘤变检出率的变化趋势[J]. 中华妇产科杂志, 2017, 52(4): 239-243. CONG Q, WANG Q, GAO S J, et al. Detection trend of vaginal intraepithelial neoplasia diagnosed by colposcopy guided biopsy from 2013 to 2015[J]. Chinese Journal of Obstetrics and Gynecology, 2017, 52(4): 239-243. [DOI] |
| [2] |
BRESHEARS L M, EDWARDS V L, RAVEL J, et al. Lactobacillus crispatus inhibits growth of Gardnerella vaginalis and Neisseria gonorrhoeae on a porcine vaginal mucosa model[J]. BMC Microbiol, 2015, 15: 276.
[DOI]
|
| [3] |
DODGE J A, ELTABBAKH G H, MOUNT S L, et al. Clinical features and risk of recurrence among patients with vaginal intraepithelial neoplasia[J]. Gynecol Oncol, 2001, 83(2): 363-369.
[DOI]
|
| [4] |
LI Z, BARRON S, HONG W, et al. Surveillance for recurrent cancers and vaginal epithelial lesions in patients with invasive cervical cancer after hysterectomy: are vaginal cytology and high-risk human papillomavirus testing useful?[J]. Am J Clin Pathol, 2013, 140(5): 708-714.
[DOI]
|
| [5] |
ZHANG S, SAITO M, YAMADA S, et al. The prevalence of VAIN, CIN, and related HPV genotypes in Japanese women with abnormal cytology[J]. J Med Virol, 2020, 92(3): 364-371.
[DOI]
|
| [6] |
ADAMS A K, WISE-DRAPER T M, WELLS S I. Human papillomavirus induced transformation in cervical and head and neck cancers[J]. Cancers, 2014, 6(3): 1793-1820.
[DOI]
|
| [7] |
HUANG B, FETTWEIS J M, BROOKS J P, et al. The changing landscape of the vaginal microbiome[J]. Clin Lab Med, 2014, 34(4): 747-761.
[DOI]
|
| [8] |
GAJER P, BROTMAN R M, BAI G, et al. Temporal dynamics of the human vaginal microbiota[J]. Sci Transl Med, 2012, 4(132): 132ra52.
[URI]
|
| [9] |
KYRGIOU M, MITRA A, MOSCICKI A B. Does the vaginal microbiota play a role in the development of cervical cancer?[J]. Transl Res, 2017, 179: 168-182.
[DOI]
|
| [10] |
STOYANCHEVA G, MARZOTTO M, DELLAGLIO F, et al. Bacteriocin production and gene sequencing analysis from vaginal Lactobacillus strains[J]. Arch Microbiol, 2014, 196(9): 645-653.
[DOI]
|
| [11] |
周丹, 崔颖, 马琳琳, 等. 绝经后老年女性阴道微生态变化[J]. 中华老年医学杂志, 2014, 33(12): 1334-1337. ZHOU D, CUI Y, MA L L, et al. Changes of vaginal microecology in elderly postmenopausal women[J]. Chinese Journal of Geriatrics, 2014, 33(12): 1334-1337. [DOI] |
| [12] |
周燕, 罗孟军, 陈莉农, 等. 4630例绝经后妇女阴道微生态状况分析[J]. 中国微生态学杂志, 2020, 23(7). ZHOU Y, LUO M J, CHEN L N, et al. Analysis of vaginal microecology in 4, 630 postmenopausal women[J]. Chinese Journal of Microecology, 2020, 23(7). [CNKI] |
| [13] |
MITRA A, MACINTYRE D A, MARCHESI J R, et al. The vaginal microbiota, human papillomavirus infection and cervical intraepithelial neoplasia: what do we know and where are we going next?[J]. Microbiome, 2016, 4(1): 58.
[DOI]
|
| [14] |
GUSTAFSSON R J, AHRNÉ S, JEPPSSON B, et al. The Lactobacillus flora in vagina and rectum of fertile and postmenopausal healthy Swedish women[J]. BMC women's health, 2011, 11(1): 17.
[DOI]
|
| [15] |
MUHLEISEN A L, HERBST-KRALOVETZ M M. Menopause and the vaginal microbiome[J]. Maturitas, 2016, 91: 42-50.
[DOI]
|
| [16] |
MITRA A, MACINTYRE D A, LEE Y S, et al. Cervical intraepithelial neoplasia disease progression is associated with increased vaginal microbiome diversity[J]. Sci Rep, 2015, 5: 16865.
[DOI]
|
| [17] |
BROTMAN R M, SHARDELL M D, GAJER P, et al. Interplay between the temporal dynamics of the vaginal microbiota and human papillomavirus detection[J]. J Infect Dis, 2014, 210(11): 1723-1733.
[DOI]
|
| [18] |
张展, 张岱, 肖冰冰, 等. 高危型HPV感染与阴道菌群及子宫颈菌群关系的初步研究[J]. 中华妇产科杂志, 2018, 53(7): 471-480. ZHANG Z, ZHANG D, XIAO B B, et al. Primary study on the relationship between high-risk HPV infection and vaginal cervical microbiota[J]. Chinese Journal of Obstetrics Gynecology, 2018, 53(7): 471-480. [DOI] |
| [19] |
LI L, DING L, GAO T, et al. Association between vaginal micro-environment disorder and cervical intraepithelial neoplasia in a community based population in China[J]. J Cancer, 2020, 11(2): 284-291.
[DOI]
|
| [20] |
MANGINO G, CHIANTORE M V, IULIANO M, et al. Inflammatory microenvironment and human papillomavirus-induced carcinogenesis[J]. Cytokine Growth Factor Rev, 2016, 30: 103-111.
|
| [21] |
COUSSENS L M, WERB Z. Inflammation and cancer[J]. Nature, 2002, 420(6917): 860-867.
[DOI]
|
| [22] |
BARTSCH H, NAIR J. Chronic inflammation and oxidative stress in the genesis and perpetuation of cancer: role of lipid peroxidation, DNA damage, and repair[J]. Langenbecks Arch Surg, 2006, 391(5): 499-510.
[PubMed]
|
| [23] |
KEMP T J, HILDESHEIM A, GARCÍA-PIÑERES A, et al. Elevated systemic levels of inflammatory cytokines in older women with persistent cervical human papillomavirus infection[J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(8): 1954-1959.
[DOI]
|
 2021, Vol. 28
2021, Vol. 28


