包膜挛缩是乳房假体植入术后最常见的并发症,复发率高。过量的肌成纤维细胞激活和细胞外基质(extracellular matrix,ECM)沉积导致植入物周围包膜增厚、变硬和收缩[1-4]。包膜挛缩是乳房假体植入术后再次手术的主要原因,迄今为止还没有有效的预防方法。包膜挛缩的病因尚不清楚。研究表明,细菌感染,尤其表皮葡萄球菌感染,与包膜挛缩的发病具有相关性[5-10]。
表皮葡萄球菌是一种条件性致病菌,一般粘附于人体的皮肤和黏膜,在生理条件下,表皮葡萄球菌对人体无害,而免疫功能低下的患者感染风险会增加。由于其具有形成细菌生物膜的能力,表皮葡萄球菌可作为病原体在宿主体内存活,生物膜保护细菌免受机体免疫系统和抗生素的清除[11-14]。本研究建立硅胶植入物周围注射细菌脂磷壁酸(lipoteichoic acid,LTA)小鼠模型,采用H-E染色、Masson染色和酶标免疫组织化学染色观察植入物周围组织结构、纤维囊厚度和纤维化反应程度;采用CD31染色计数新生血管数量;采用定量PCR检测炎症因子mRNA水平;采用Ki-67/半胱氨酸天冬氨酸蛋白酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)染色计数增殖/凋亡细胞,旨在明确细菌感染对乳房假体植入术后包膜挛缩形成的作用。
1 材料与方法 1.1 实验动物C57BL/6小鼠,成年,雄性,共12只。设植入物周围注射细菌LTA组,以植入物周围注射生理盐水为对照组,随机分组,每组6只。动物实验经复旦大学附属中山医院实验伦理委员会审批(2016-123)。
1.2 硅胶植入物周围注射细菌LTA模型成年雄性C57BL/6小鼠,戊巴比妥钠(50 mg/kg)腹腔内注射麻醉。无菌条件下在小鼠背部皮下置入0.2 cm×0.2 cm硅胶植入物,丝线缝合。在植入物周围皮下注射细菌LTA(10 μg/mL,每个植入物周围20 μL)。LTA第1次注射2 h后用于定量PCR检测。LTA注射每次间隔48 h,注射6次后用于H-E染色、Masson染色和酶标免疫组织化学染色。
1.3 Masson染色石蜡切片脱蜡至蒸馏水。苏木素染5~10 min。盐酸酒精混合液分化。流动水蓝化,蒸馏水洗。丽春红酸性品红液中染5~8 min。蒸馏水洗。1%磷钼酸中染1~3 min。不用水洗,直接入苯胺蓝液或亮绿液5 min。水速洗,置60℃温箱中烘干,二甲苯透明,封片固定。
1.4 酶标免疫组织化学染色选取染色效果好与H-E染色同批次白片,烤片20 min。3%过氧化氢37℃,静置10 min以消除内源性过氧化物酶。抗原微波修复,室温冷却。封闭。室温一抗孵育,45 min。二抗-酶标聚物37℃放置30 min。DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。
1.5 定量PCR采用定量PCR分析移植物周围LTA注射组和生理盐水注射组炎症因子相关基因的表达。按照TRIzol(Thermo Fisher Scientific,美国)操作步骤提取植入物周围组织总RNA。使用PrimeScriptTM RT reagent kit试剂盒(Takara,日本),逆转录后,用TB GreenTM Premix Ex TaqTM试剂盒(Takara,日本)行定量PCR检测。设计白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、Toll样受体2(toll-like receptor 2,TLR2)和干扰素-γ(interferon-γ,IFN-γ)特异性引物,由Invitrogen公司合成,引物序列详见表 1。95℃孵育5 min预变性,95℃孵育10 s变性,60℃ 30 s退火/延伸,共40个循环。以各目的基因与Gapdh表达比值为其相对表达量。各样品重复测量3次。
| 基因 | 上游引物序列(5′→3′) | 下游引物序列(5′→3′) |
| IL-6 | ACT TCC ATC CAG TTG CCT TCT TGG | TTA AGC CTC CGA CTT GTG AAG TGG |
| TNF-α | GCG ACG TGG AAC TGG CAG AAG | GCC ACA AGC AGG AAT GAG AAG AGG |
| TLR2 | GCG ACA TCC ATC ACC TGA CTC TTC | GCC TCG GAA TGC CAG CTT CTT C |
| IFN-γ | CAG GCC ATC AGC AAC AAC ATA AGC | AGC TGG TGG ACC ACT CGG ATG |
计量资料用x±s表示。组间比较用方差分析,同组数据前后比较用配对t检验(paired t-test),两组间比较用t检验(Student’s test)。不同的组织切片来自于不同的实验动物。检验水准(α)为0.05。
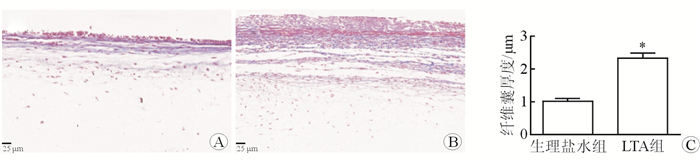
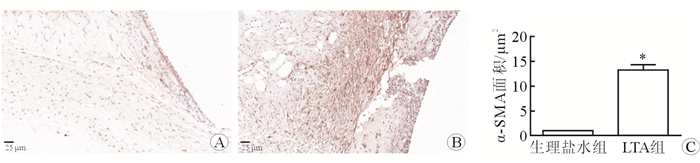
2 结果 2.1 细菌LTA对植入物周围纤维化反应的作用采用硅胶植入物周围注射细菌LTA模型,Masson染色结果显示:生理盐水注射组的植入物周围形成一层薄的蓝色纤维囊;与生理盐水注射组比较,细菌LTA注射组的植入物周围纤维囊厚度增加了(1.3±0.08)倍(P < 0.05),呈蓝色和红色(变性纤维结缔组织),见图 1。结果显示:与生理盐水组注射比较,细菌LTA注射组α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)面积增加了(12.38±0.91)倍(P < 0.05),见图 2。
|
| 图 1 植入物周围注射细菌LTA对纤维囊厚度的作用 A:生理盐水组;B:LTA组;C:注射细菌LTA增加植入物周围纤维囊厚度. *P < 0.01与对照组相比 |
|
| 图 2 植入物周围注射细菌LTA对纤维化反应的作用 A:生理盐水组;B:LTA组;C:注射细菌LTA增加植入物周围α-SMA面积. *P < 0.01与生理盐水组相比 |
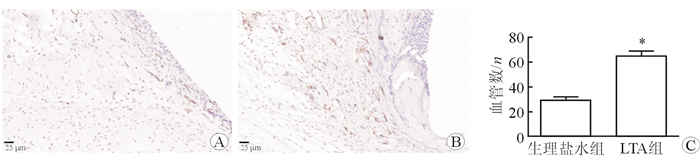
采用CD31染色标记血管内皮细胞,研究细菌LTA对植入物周围新生血管数量的作用。结果(图 3)显示,生理盐水注射组植入物周围新生血管数量为每视野(29±2.65)根,细菌LTA注射组植入物周围新生血管数量为(64±4.85)根,注射细菌LTA增加植入物周围新生血管数量(P < 0.05)。
|
| 图 3 植入物周围注射细菌LTA对新生血管数量的作用 A:生理盐水组;B:LTA组;C:注射细菌LTA增加植入物周围新生血管数量. *P < 0.01与生理盐水组相比 |
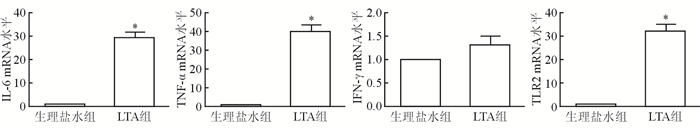
采用定量PCR检测植入物周围炎症因子,结果(图 4)显示:与生理盐水组比较,细菌LTA注射组增加植入物周围IL-6 (P < 0.05)和TNF-α mRNA水平(P < 0.05),不改变IFN-γ mRNA水平。
|
| 图 4 植入物周围注射细菌LTA对炎症反应的作用 *P < 0.01与生理盐水组相比 |
细菌LTA的受体是TLR2,采用定量PCR检测植入物周围TLR2 mRNA水平。与生理盐水组比较,细菌LTA注射组提高植入物周围TLR2 mRNA水平(P < 0.05)。
2.3 细菌LTA对植入物周围细胞增殖、凋亡的作用分别采用免疫组织化学方法,以Ki-67和Caspase-3染色标记植入物周围增殖细胞和凋亡细胞。结果显示:生理盐水组注射组植入物周围Ki-67阳性细胞数为(48±3.67)个,细菌LTA注射组为(115±8.72)个,注射细菌LTA增加植入物周围增殖细胞数量(P < 0.05),见图 5。生理盐水组注射组植入物周围Caspase-3阳性细胞数为(38±2.65)个,细菌LTA注射组为(144±9.85)个,注射细菌LTA增加植入物周围凋亡细胞数量(P < 0.05),见图 6。
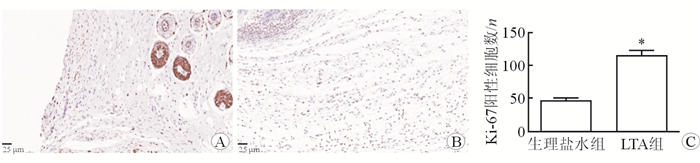
|
| 图 5 植入物周围注射细菌LTA对增殖细胞的作用 A:生理盐水组;B:LTA组;C:注射细菌LTA增加植入物周围Ki-67阳性细胞数量. *P < 0.01与生理盐水组相比 |

|
| 图 6 植入物周围注射细菌LTA对凋亡细胞的作用 A:生理盐水组;B:LTA组;C:注射细菌LTA增加植入物周围Caspase-3阳性细胞数量. *P < 0.01与生理盐水组相比 |
细菌感染与乳房假体植入术后包膜挛缩具有相关性。细菌感染在包膜挛缩发病过程中的作用有待证实。本研究表明,多次注射细菌LTA增加植入物周围纤维囊厚度和纤维化反应,增加新生血管数量,增加IL-6、TNF-α、IFN-γ和TLR2 mRNA水平,增加增殖和凋亡细胞数量。
表皮葡萄球菌是条件致病菌,在生理条件下对人体无害;免疫功能低下的患者感染风险增加。由于其形成细菌生物膜的能力,表皮葡萄球菌可以作为病原体在宿主体内存活。LTA是革兰阳性菌(如表皮葡萄球菌)细胞壁的组分,是核糖醇或甘油残基由磷酸二键连接而成的多聚物。LTA的抗原性很强,是细菌的重要表面抗原。某些细菌的LTA能粘附在人类细胞表面,与致病性有关[15-17]。本研究结果显示,多次局部注射细菌LTA能够增加植入物周围纤维囊厚度、纤维化反应和炎症反应等,提示LTA是细菌感染诱发乳房假体植入术后包膜挛缩的充分条件,对提出预防包膜挛缩新策略具有重要意义。
已有文献[18-24]报道,炎症因子IL-6调控白细胞浸润参与宿主对细菌的急性防御反应;IL-6-/-转基因小鼠无法有效清除细菌感染;相反,在慢性疾病炎症模型中,IL-6是慢性炎症和纤维化的驱动因子。本研究结果显示,移植物周围局部注射LTA增加IL-6 mRNA水平,提示细菌LTA诱发的包膜挛缩与炎症因子IL-6具有相关性。
机体对病原微生物有固有性免疫和适应性免疫2种应答方式。病原微生物感染与宿主的免疫状态密切相关,免疫力完全正常的宿主,固有性免疫足以将病原微生物清除;当感染趋向于慢性,或者宿主曾被致敏,则适应性免疫应答迅速启动[25-27]。本研究结果显示,多次局部注射细菌LTA增加植入物周围纤维囊厚度,提示多次细菌感染或者细菌感染诱发的慢性炎症过程与包膜挛缩的发生有关。
纤维囊是由成纤维细胞分裂、增殖、迁移,产生ECM形成的纤维结缔组织。纤维化的过程包括:网状纤维胶原化,胶原纤维变粗;成纤维细胞减少,炎细胞先后消失;新生血管退化,留下很少的小动脉及小静脉,质地坚韧,具有收缩性。本研究显示,在纤维囊形成的过程中,LTA局部注射组,增殖细胞和凋亡细胞数量都增加;新生血管数量增加,提示实验中LTA注射6次后取材,仍处于纤维囊形成、增厚的过程。
综上所述,多次局部注射细菌LTA会增加植入物周围纤维囊厚度,局部、反复或慢性细菌感染是乳房假体植入术后致包膜挛缩发病的充分条件,细菌LTA是促进纤维化反应的致病物质。
| [1] |
ARACO A, CARUSO R, ARACO F, et al. Capsular contractures:a systematic review[J]. Plast Reconstr Surg, 2009, 124(6): 1808-1819.
[DOI]
|
| [2] |
BACHOUR Y, VERWEIJ S P, GIBBS S, et al. The aetiopathogenesis of capsular contracture:a systematic review of the literature[J]. J Plast Reconstr Aesthet Surg, 2018, 71(3): 307-317.
|
| [3] |
BUI J M, PERRY T, REN C D, et al. Histological characterization of human breast implant capsules[J]. Aesthetic Plast Surg, 2015, 39(3): 306-315.
[DOI]
|
| [4] |
MARQUES M, BROWN S A, OLIVEIRA I, et al. Long-term follow-up of breast capsule contracture rates in cosmetic and reconstructive cases[J]. Plast Reconstr Surg, 2010, 126(3): 769-778.
[DOI]
|
| [5] |
ADAMS W P J R. Discussion:subclinical (biofilm) infection causes capsular contracture in a porcine model following augmentation mammaplasty[J]. Plast Reconstr Surg, 2010, 126(3): 843-844.
[DOI]
|
| [6] |
DANINO M A, NIZARD N, PAEK L S, et al. Do bacteria and biofilm play a role in double-capsule formation around macrotextured implants?[J]. Plast Reconstr Surg, 2017, 140(5): 878-883.
[DOI]
|
| [7] |
DRINANE J J, KORTES M J, BERGMAN R S, et al. Evaluation of antibiotic irrigation versus saline irrigation in reducing the long-term incidence and severity of capsular contraction after primary augmentation mammoplasty[J]. Ann Plast Surg, 2016, 77(1): 32-36.
[DOI]
|
| [8] |
KIM Y S. Do bacteria and biofilm play a role in double-capsule formation around macrotextured implants?[J]. Plast Reconstr Surg, 2018, 142(4): 588e-589e.
|
| [9] |
RIEGER U M, MESINA J, KALBERMATTEN D F, et al. Bacterial biofilms and capsular contracture in patients with breast implants[J]. Br J Surg, 2013, 100(6): 768-774.
[DOI]
|
| [10] |
TAMBOTO H, VICKERY K, DEVA A K. Subclinical (biofilm) infection causes capsular contracture in a porcine model following augmentation mammaplasty[J]. Plast Reconstr Surg, 2010, 126(3): 835-842.
[URI]
|
| [11] |
FRODERMANN V, CHAU T A, SAYEDYAHOSSEIN S, et al. A modulatory interleukin-10 response to staphylococcal peptidoglycan prevents Th1/Th17 adaptive immunity to Staphylococcus aureus[J]. J Infect Dis, 2011, 204(2): 253-262.
[DOI]
|
| [12] |
JAŚKIEWICZ M, JANCZURA A, NOWICKA J, et al. Methods used for the eradication of Staphylococcal biofilms[J]. Antibiotics (Basel), 2019, 8(4): pii:E174.
[DOI]
|
| [13] |
LI Z, PERES A G, DAMIAN A C, et al. Immunomodulation and disease tolerance to Staphylococcus aureus[J]. Pathogens, 2015, 4(4): 793-815.
[DOI]
|
| [14] |
THAMMAVONGSA V, KIM H K, MISSIAKAS D, et al. Staphylococcal manipulation of host immune responses[J]. Nat Rev Microbiol, 2015, 13(9): 529-543.
[DOI]
|
| [15] |
ISRAEL L, WANG Y, BULEK K, et al. Human adaptive immunity rescues an inborn error of innate immunity[J]. Cell, 2017, 168(5): 789-800.
[URI]
|
| [16] |
SNYDER-MACKLER N, SANZ J, KOHN J N, et al. Social status alters immune regulation and response to infection in macaques[J]. Science, 2016, 354(6315): 1041-1045.
[DOI]
|
| [17] |
TANG A T, CHOI J P, KOTZIN J J, et al. Endothelial TLR4 and the microbiome drive cerebral cavernous malformations[J]. Nature, 2017, 545(7654): 305-310.
[DOI]
|
| [18] |
DETOURNAY O, MAZOUZ N, GOLDMAN M, et al. IL-6 produced by type Ⅰ IFN DC controls IFN-gamma production by regulating the suppressive effect of CD4+ CD25+ regulatory T cells[J]. Hum Immunol, 2005, 66(5): 460-468.
[DOI]
|
| [19] |
DIENZ O, RUD J G, EATON S M, et al. Essential role of IL-6 in protection against H1N1 influenza virus by promoting neutrophil survival in the lung[J]. Mucosal Immunol, 2012, 5(3): 258-266.
[DOI]
|
| [20] |
DOGANCI A, EIGENBROD T, KRUG N, et al. The IL-6R alpha chain controls lung CD4+CD25+ Treg development and function during allergic airway inflammation in vivo[J]. J Clin Invest, 2005, 115(2): 313-325.
[URI]
|
| [21] |
DOMINITZKI S, FANTINI M C, NEUFERT C, et al. Cutting edge:trans-signaling via the soluble IL-6R abrogates the induction of FoxP3 in naive CD4+ CD25+ T cells[J]. J Immunol, 2007, 179(4): 2041-2045.
[DOI]
|
| [22] |
JONES S A. Directing transition from innate to acquired immunity:defining a role for IL-6[J]. J Immunol, 2005, 175(6): 3463-3468.
[DOI]
|
| [23] |
JONES S A, SCHELLER J, ROSE-JOHN S. Therapeutic strategies for the clinical blockade of IL-6/gp130 signaling[J]. J Clin Invest, 2011, 121(9): 3375-3383.
|
| [24] |
NISHIMOTO N, KISHIMOTO T. Inhibition of IL-6 for the treatment of inflammatory diseases[J]. Curr Opin Pharmacol, 2004, 4(4): 386-391.
[DOI]
|
| [25] |
CUI X, MINO T, YOSHINAGA M, et al. Regnase-1 and Roquin nonredundantly regulate Th1 differentiation causing cardiac inflammation and fibrosis[J]. J Immunol, 2017, 199(12): 4066-4077.
[DOI]
|
| [26] |
NASTASE M V, ZENG-BROUWERS J, BECKMANN J, et al. Biglycan, a novel trigger of Th1 and Th17 cell recruitment into the kidney[J]. Matrix Biol, 2018, 68-69: 293-317.
[DOI]
|
| [27] |
WEN J, ZHOU Y, WANG J, et al. Interactions between Th1 cells and Tregs affect regulation of hepatic fibrosis in biliary atresia through the IFN-γ/STAT1 pathway[J]. Cell Death Differ, 2017, 24(6): 997-1006.
[DOI]
|
 2020, Vol. 27
2020, Vol. 27


