2. 复旦大学附属中山医院内镜中心, 上海 200032
2. Department of Endoscopy Center, Zhongshan Hospital, Fudan University, Shanghai 200032, China
胃癌是最常见的恶性肿瘤之一,病死率在所有恶性肿瘤中位于第三位[1]。胃癌发病被认为是一个多阶段进行性发展的过程, 包括浅表性胃炎-萎缩性胃炎-胃黏膜肠上皮化生(gastric intestinal metaplasia,GIM)-胃黏膜上皮内瘤变-肠型胃癌[2]。其中GIM为胃癌癌前状态,GIM的病理组织学分级和胃的分布范围与胃癌发生率密切相关[3]。
病理学检查是诊断GIM的金标准。GIM在常规白光内镜检查(esophagogastroduodenoscopy,EGD)下的表现缺乏特异性,所以常规内镜诊断GIM仍较困难[4]。醋酸染色(acetic acid chromoendoscopy, ACC)是一种染色内镜技术,在肠化柱状上皮可产生白化增强和延迟褪色现象[5]。窄带成像(narrow band imaging,NBI)是一种电子染色技术,可利用窄带光来强化黏膜表面结构的视觉图像。本研究比较EGD模式、ACC模式、ACC+NBI模式对GIM的诊断效果,并评估ACC+NBI模式对GIM的筛查价值。
1 资料与方法 1.1 研究对象收集2018年4月至6月就诊于复旦大学附属金山医院的幽门螺杆菌(helicobacter pylori, HP)抗体血清学阳性患者资料,共纳入93例。纳入标准:40~75岁的HP抗体血清学阳性患者。排除标准:(1)有进展期胃癌、胃切除手术史、胃活动性出血患者;(2)近期使用抗血小板药物, 抗凝药物或凝血功能异常患者; (3)对醋酸过敏者;(4)不同意接受该检查患者;(5)各种原因无法完成内镜检查者。本研究经过本院伦理委员会批准,患者均知情本研究并签署知情同意书。
1.2 设备与材料内镜主机为Olympus 290(奥林巴斯,日本),内镜为Olympus GIF-HQ290(奥林巴斯,日本),喷洒管为链蛋白酶颗粒(2万U/袋,泰德制药,中国),二甲硅油散剂5 g(含0.3g二甲硅油,健能制药,中国),6%醋酸(500 mL/瓶,宝鼎酿造,中国)。
1.3 内镜前准备患者于内镜检查开始前20 min口服链蛋白酶颗粒20 000 U、5%碳酸氢钠溶液20 mL、二甲硅油散5 g、生理盐水30 mL组成的混合液,以祛除胃黏膜表面的黏液和泡沫。所有患者由麻醉师采用丙泊酚静脉麻醉。6%醋酸5 mL加入15 mL蒸馏水配制成1.5%醋酸溶液[6-7]。
1.4 内镜操作过程冲洗完胃腔后,常规对全胃各部分仔细观察,拍摄并记录有无GIM病灶。观察结束后自胃窦至胃体均匀喷洒稀释至1.5%的醋酸溶液,30 s后在EGD模式下观察并记录有无白化增强病灶。然后切换至NBI光学模式进行观察,同样判定有无白化增强病灶。
1.5 肠化病灶判定和表面结构分类喷洒醋酸后胃肠化黏膜可表现为一过性白化现象,GIM病灶处可出现白化增强及白化延迟,NBI下观察可使白化效果更加增强,与正常胃黏膜有明显分界。根据醋白反应不同特点做出判断[8-9]:正常白化;减弱白化;增强白化。对存在增强白化且有明显分界线的病灶可判定为GIM可能,并近焦观察,参照Tanaka[5]增强放大内镜对胃黏膜表面结构进行分型,详见图 1,最后结合病理结果进行分类。
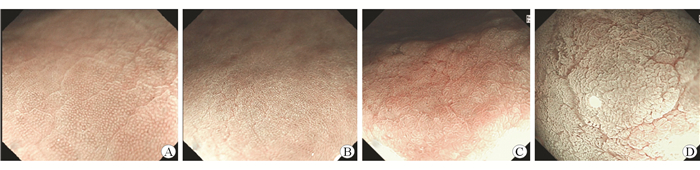
|
| 图 1 喷洒醋酸后增强的胃黏膜表面微结构 A:typeⅠ型,胃小凹呈大小、排列规则的小类圆型结构,正常白化;B:typeⅡ型,胃小凹呈裂隙样规则排列,正常白化;C:type Ⅲ型,胃小凹裂隙样规则排列,扩大、不平,白化减弱;D:type Ⅳ型,胃小凹成绒毛状、短指状隆起规则排列,白化增强 |
先予以常规EGD观察摄图,如发现可疑肠化病灶,则由助手在图像上标记可疑肠化病灶,如未发现可疑肠化病灶则不标记。同样方法进行ACC和NBI+ACC观察。最后按3种观察模式各自标记点分别进行活检并记录。如未发现可疑肠化病灶,则按新悉尼系统标准[10]对胃窦大弯、胃窦小弯、胃角、胃体大弯、胃体小弯处进行至少5点活检。
1.7 病理学检测每位患者均进行活检,所有活检标本均固定在4%的福尔马林溶液,包埋于石蜡中进行H-E染色。所有标本由同一位丰富经验的病理医生进行检测,该医生对本研究中所有患者的内镜诊断均不知情。GIM病理诊断标准参照新悉尼系统分类法[10]。
1.8 统计学处理采用SPSS 17.0对数据进行分析,采用χ2检验对2组进行比较。以病理组织学为参考值, 绘制ROC曲线,比较3种模式下的诊断效果,并对结果进行Kappa一致性检验。检验水准(α)为0.05。
2 结果 2.1 患者一般资料本研究共纳入93例病例。患者平均年龄为57.2岁,男性42例(45%),女性51例(55%),63例患者病理诊断为GIM,见表 1。
| 指标 | 结果 |
| 纳入患者(n) | 93 |
| 平均年龄(岁) | 57.2 |
| 性别n(%) | |
| 男 | 42(45) |
| 女 | 51(55) |
| 胃黏膜肠上皮化生n(%) | |
| 阳性 | 63(68) |
| 阴性 | 30(32) |
病理诊断为金标准。EGD模式下发现疑似GIM病例23例,其中19例经病理诊断为GIM;ACC模式观察发现疑似GIM病例52例,其中47例经病理诊断为GIM;ACC+NBI模式观察发现疑似GIM病例64例,其中58例经病理诊断为GIM,见表 2。
| 观察模式 | 内镜诊断 | n | 病理诊断 | |
| GIM(+) | GIM(-) | |||
| EGD | GIM(+) | 23 | 19 | 4 |
| GIM(-) | 70 | 44 | 26 | |
| ACC | GIM(+) | 52 | 47 | 5 |
| GIM(-) | 41 | 16 | 25 | |
| ACC+NBI | GIM(+) | 64 | 58 | 6 |
| GIM(-) | 29 | 5 | 24 | |
在EGD下判断为GIM阴性的70例患者中有28例通过ACC观察发现并病理诊断为GIM,在ACC判定为GIM阴性的41例患者中有11例患者通过ACC+NBI观察发现并病理诊断为GIM,详见图 2。
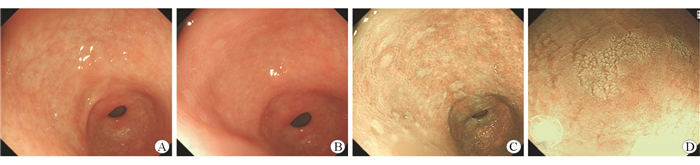
|
| 图 2 典型病例3种观察模式下GIM检查图像 A:白光下胃窦小弯图像,未见明显GIM病灶;B:醋酸染色后下胃窦小弯图像,可见散在白化灶不明显;C:切换至NBI下观察,可见明显的多处增强白化灶,分界明显;D:近距离切换至近焦模式,可见增强白化病灶表面结构成短绒毛状,分界清楚,type Ⅳ型,活检病理为GIM,中度 |
结果(图 3、表 3)显示,EGD模式的灵敏度为30.16%,特异度为86.67%,AUC为0.584;ACC模式的诊断灵敏度为74.60%,特异度为83.33%,AUC为0.790;ACC+NBI模式的诊断灵敏度为92.06%,特异度为80.00%,AUC为0.860。3种模式诊断灵敏度的差异均有统计学意义(P<0.01),特异度差异均无统计学意义。

|
| 图 3 3种观察模式下诊断的ROC曲线图 |
| 观察模式 | 灵敏度%(95%CI) | 特异度%(95%CI) | AUC(95%CI) | Kappa值 |
| EGD | 30.16(19.2~43.0) | 86.67(69.3~96.2) | 0.584(0.477~0.685) | 0.125 |
| ACC | 74.60(62.1~84.7) | 83.33(65.3~94.4) | 0.790(0.693~0.867) | 0.529 |
| ACC+NBI | 92.06(82.4~97.4) | 80.00(61.4~92.3) | 0.860(0.773~0.923) | 0.727 |
EGD、ACC和ACC+NBI与病理结果的一致性Kappa值分别为0.125(P=0.079),0.529(P<0.001),0.727(P<0.001)。EGD与病理结果的一致性较差,ACC与病理结果的一致性中等,而ACC+NBI与病理结果的一致性较高,见表 3。
3 讨论目前国内外对胃黏膜GIM的评估参照OLGIM(operative link for gastric intestinal metaplasia assessment)方案[11-12]。OLGIM是从慢性胃炎新悉尼系统发展而来的,认为分期为Ⅲ/Ⅳ期为胃癌高风险患者[13]。评估中需要对胃窦大小弯、胃角、胃体大弯、胃体小弯进行多点活检。GIM病灶在常规内镜下表现为淡黄色、瓷白色小结节,或呈弥漫型及鱼鳞状颗粒型。大部分为多灶性糜烂、水肿,与非萎缩性糜烂较难区别,常规内镜下表现的特异性不高,检出率仅12%~38%[14-15],所以OLGIM在临床实际应用时存在活检遗漏或者随机抽样活检,导致OLGIM评估准确性不足。
近年来内镜技术的发展增加了GIM的检查方法,如染色内镜(亚甲蓝、醋酸)、NBI、共聚焦激光内窥镜等[16-18],但目前尚无统一的染色内镜诊断标准。ACC是利用醋酸使柱状上皮细胞内细胞质蛋白的可逆变性,从而使柱状上皮黏膜结构产生变化,更加容易被识别。ACC与放大内镜结合技术最早由Guelrud等[5-6]报道,用于识别Barrett食管中的肠化病灶,并将其命名为增强放大内镜。Tanaka首次将ACC用于胃部内镜检查,可有效识别GIM。但在实际操作中ACC的白化增强在白光内镜检查中并不都是十分明显,特别是散在分布的肠化病灶不容易被分辨。当病灶醋白反应不明显时,会给医生带来困惑导致误诊,主观性很强。NBI是一种内窥镜成像技术,可识别GIM特有的“亮蓝脊征”,对GIM的诊断敏感性可达89%,特异性为93%[19-20]。但是NBI是弱光,并不适合做中远景观察[21],也只能在白光下发现可疑病灶后抵近观察才能起作用,无法在全胃范围达到筛查目的。
本研究先全胃喷洒醋酸进行染色,使GIM病灶黏膜表面结构发生变化。然后利用NBI的窄波特点来强化醋酸对GIM病灶的白化效果,利用NBI的弱光特点提高了GIM病灶与周围正常黏膜的对比度,从而增加了病灶检出率。研究中ACC+NBI模式下对GIM诊断灵敏度达92.06%,明显高于常规EGD的30.16%和ACC模式的74.60%。研究中也发现在ACC模式下诊断为GIM阴性的41例患者中有11例患者通过ACC+NBI观察发现并病理诊断为GIM,表明ACC+NBI模式在对GIM诊断灵敏度上确实要优于ACC模式。ROC曲线分析结果显示,ACC+NBI模式的AUC大于ACC模式,且完全包含无相交,显示ACC+NBI方法要优于ACC方法。ACC+NBI模式与病理结果的一致性Kappa值为0.727,一致性较高,明显优于ACC组(0.529)。表明ACC+NBI方法能很好地帮助医生进行GIM病灶筛查。
本研究也存在不足之处:(1)由于常规胃镜检查体位原因,胃底及胃体大弯上部常常为重力最低位,所以喷洒后的醋酸往往积聚在胃底处,导致该部位黏膜在醋酸持续作用下处于持续白化状态。故ACC无法对胃底及胃体大弯上部黏膜进行有效识别,容易误判,出现假阳性诊断。由于研究中胃底及胃体大弯上部出现GIM的病例仅1例,故无法判断该影响;(2)由于本研究醋酸染色后,先进行常规EGD然后再NBI模式观察,且不同个体白化延迟时间不同。为了保证能在NBI模式下能观察到醋酸白化现象,所以EGD在染色后30~90 s内进行,约60 s的时间也可能导致医生无法完全详尽地观察,影响ACC观察的数据准确性;(3)研究发现ACC+NBI模式对散在分布的小病灶检出优势较明显,但对大范围的GIM较EGD和ACC无明显优势;(4)目前未发现内镜下表现与其病理组织学肠化严重程度分级有关联。
综上所述,随着国内胃癌早期筛查工作的广泛开展,除了提高早期胃癌诊断能力,如何通过OLGIM分级进行管理和随访好胃癌高风险人群也是很重要的前期工作。内镜下ACC+NBI观察模式可以快速显示胃黏膜GIM病灶,是胃黏膜GIM诊断的良好工具。
| [1] |
FOCK K M. Review article:the epidemiology and prevention of gastric cancer[J]. Aliment Pharmacol Ther, 2014, 40(3): 250-260.
[URI]
|
| [2] |
CORREA P. Human gastric carcinogenesis:a multistep and multifactorial process-First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention[J]. Cancer Res, 1992, 52: 6735-6740.
[URI]
|
| [3] |
KIM Y I, KOOK M C, CHO S J, et al. Effect of biopsy site on detection of gastric cancer high-risk groups by OLGA and OLGIM stages[J]. Helicobacter, 2017, 22(6).
[URI]
|
| [4] |
黄永辉, 周丽雅, 林三仁, 等. 胃粘膜萎缩、肠上皮化生及异型增生的放大内镜表现及诊断价值[J]. 中华消化内镜杂志, 2005, 22(4): 231-235. [CNKI]
|
| [5] |
TANAKA K, TOYODA H, KADOWAKI S, et al. Features of early gastric cancer and gastric adenoma by enhanced-magnification endoscopy[J]. J Gastroenterol, 2006, 41(4): 332-338.
[URI]
|
| [6] |
GUELRUD M, HERRERAL I, ESSENFELD H, et al. Enhanced magnification endoscopy:a new technique to identify specialized intestinal metaplasia in Barrett's esophagus[J]. Gastrointest Endosc, 2001, 53(6): 559-565.
[URI]
|
| [7] |
LAMBERT R, REY J F, SANKARANARAYANAN R. Magnification and chromoscopy with the acetic acid test[J]. Endoscopy, 2003, 35(5): 437-445.
[URI]
|
| [8] |
POGUE B W, KAUFMAN H B, ZELENCHUK A, et al. Analysis of acetic acid-induced whitening of high-grade squamous intraepithelial lesions[J]. J Biomed Opt, 2001, 6(4): 397-403.
[URI]
|
| [9] |
YAGI K, ARUGA Y, NAKAMURA A, et al. The study of dynamic chemical magnifying endoscopy in gastric neoplasia[J]. Gastrointest Endosc, 2005, 62(6): 963-969.
[URI]
|
| [10] |
DIXON M F, GENTA R M, YARDLEY J H, et al. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994[J]. Am J Surg Pathol, 1996, 20(10): 1161-1181.
[URI]
|
| [11] |
RUGGE M, GENTA R M. Staging and grading of chronic gastritis[J]. Hum Pathol, 2005, 36(3): 228-233.
[URI]
|
| [12] |
CAPELLE L G, DE VRIES A C, HARINGSMA J, et al. The staging of gastritis with the OLGA system by using intestinal metaplasia as an accurate alternative for atrophic gastritis[J]. Gastrointest Endosc, 2010, 71(7): 1150-1158.
[URI]
|
| [13] |
RUGGE M, DE BONI M, PENNELLI G, et al. Gastritis OLGA-staging and gastric cancer risk:a twelve-year clinicopathological followup study[J]. Aliment Pharmacol Ther, 2010, 31(10): 1104-1111.
|
| [14] |
KAMINISHI M, YAMAGUCHI H, NOMURA S, et al. Endoscopic classification of chronic gastritis based on a pilot study by the research society for gastritis[J]. Digest Endosc, 2002, 14(4): 138-151.
[URI]
|
| [15] |
AN J K, SONG G A, KIM G H, et al. Marginal turbid band and light blue crest, signs observed in magnifying narrow-band imaging endoscopy, are indicative of gastric intestinal metaplasia[J]. BMC gastroenterol, 2012, 12: 169.
[URI]
|
| [16] |
DINIS-RIBEIRO M, DA COSTA-PEREIRA A, LOPES C, et al. Magnification chromoendoscopy for the diagnosis of gastric intestinal metaplasia and dysplasia[J]. Gastrointest Endosc, 2003, 57(4): 498-504.
[URI]
|
| [17] |
CAPELLE L G, HARINGSMA J, DE VRIES A C, et al. Narrow band imaging for the detection of gastric intestinal metaplasia and dysplasia during surveillance endoscopy[J]. Dig Dis Sci, 2010, 55(12): 3442-3448.
[URI]
|
| [18] |
TAGHAVI S A, MEMBARI M E, ESHRAGHIAN A, et al. Comparison of chromoendoscopy and conventional endoscopy in the detection of premalignant gastric lesions[J]. Can J Gastroenterol, 2009, 23(2): 105-108.
[URI]
|
| [19] |
BARBEIRO S, LIBÂNIO D, CASTRO R, et al. Narrow-band imaging:clinical application in gastrointestinal endoscopy[J]. GE Port J Gastroenterol, 2018, 26(1): 40-53.
[URI]
|
| [20] |
UEDO N, ISHIHARA R, IISHI H, et al. A new method of diagnosing gastric intestinal metaplasia:narrow-band imaging with magnifying endoscopy[J]. Endoscopy, 2006, 38(8): 819-824.
[URI]
|
| [21] |
ASGE Technology Committee, SONG L M, ADLER D G, et al. Narrow band imaging and multiband imaging[J]. Gastrointest Endosc, 2008, 67(4): 581-589.
[URI]
|
 2020, Vol. 27
2020, Vol. 27


