2. 洛阳市内分泌代谢病临床医学研究中心, 洛阳 471003
2. Clinical Medicine Research Center of Endocrine and Metabolic Diseases of Luoyang, Luoyang 471003, Henan, China
心血管自主神经病变(cardiovascular autonomic neuropathy,CAN)是糖尿病最常见且最严重的慢性并发症之一,也是2型糖尿病死亡率增加的独立预测因子[1]。强化多因素干预可延缓CAN的发生发展[2],因此及时诊断CAN并进行早期干预意义重大。经典的心血管反射试验(cardiovascular reflex tests, CARTs)诊断CAN较为繁琐费时,临床上难以常规开展。近年来,有研究[3]表明复合自主神经症状评分-31(composite autonomic symptom score-31, COMPASS-31)对小纤维神经病变诊断效能良好,但其在2型糖尿病CAN中诊断价值的研究较少。因此,本研究以CARTs为CAN诊断金标准,分析探讨COMPASS-31评分对2型糖尿病CAN的诊断价值。
1 资料与方法 1.1 研究对象采用横断面研究,以2018年10月至2019年05月纳入河南科技大学第一附属医院内分泌代谢科收治的105例2型糖尿病患者为研究对象。纳入标准:(1)符合1999年WHO公布的2型糖尿病诊断标准[4];(2)年龄在18~75周岁。排除标准:(1)1型糖尿病或其他类型糖尿病;(2)经病史、体格检查或辅助检查明确伴有心肌梗死、心力衰竭、心绞痛、心律失常、先天性心脏病等严重心血管疾病者;(3)急性并发症,如糖尿病酮症酸中毒、高血糖高渗状态等;(4)急性脑血管病、感染、发热、手术等所致应激状态,或危及生命的代谢紊乱;(5)重度贫血、甲状腺疾病、肺、肝、肾及其他系统严重疾病;(6)精神疾病或神经症;(7)近1个月内服用影响心率的药物,如β受体阻滞剂、抗心绞痛药等;(8)妊娠妇女及哺乳期妇女;(9)增殖性视网膜病变;(10)无法配合完成检查者。所有研究对象均对本研究知情同意并签署知情同意书,本研究经河南科技大学第一附属医院伦理委员会批准。
1.2 临床资料采集及辅助检查询问病史,记录患者性别、年龄、糖尿病病程、糖尿病家族史、吸烟史、饮酒史及高血压史。测量身高、体质量、腰围、臀围、收缩压、舒张压、静息心率,计算体质指数、腰臀比。实验室检查包括空腹血糖、糖化血红蛋白、血脂及肾功能指标。糖尿病并发症检查包括:糖尿病周围神经病变、糖尿病肾病、糖尿病视网膜病变。糖尿病周围神经病变由肌电图诊断;糖尿病肾病由尿白蛋白/肌酐比值诊断;糖尿病视网膜病变由眼底照相诊断。
1.3 复合自主神经症状评分-31(COMPASS-31)COMPASS-31评分包括6个领域,共31个条目,来评估自主神经症状的严重程度:直立不耐受(4项,0~40分),血管舒缩功能(3项,0~5分),分泌功能(4项,0~15分),胃肠道功能(12项,0~25分),膀胱功能(3项,0~10分),瞳孔运动功能(5项,0~5分),总分为100分,分数越高,自主神经病变程度越严重。对所有研究对象进行COMPASS-31评分[5],向其讲明每个问题的含义,保证客观真实完成,所有评分均由同一医师负责。
1.4 CAN的诊断与分组采用CARTs诊断CAN,测试前一天及当天避免剧烈运动,测试前至少2 h避免浓茶、咖啡和饮酒,饭后2 h进行测试,检查前至少卧床休息20 min,每项测试间隔5 min[6]。所有测试均由同一名训练有素的医师完成。操作方法[7-8]:(1)瓦氏动作指数:测定瓦氏动作后最长R-R间期与瓦氏动作时最短R-R间期的比值(正常:≥1.21,临界:1.11~1.20,异常:≤1.10);(2)深呼吸心率差:测定每个呼吸周期深吸气时最短的R-R间期和深呼气时最长的R-R间期,换算为心率,计算心率差,取6个呼吸周期的平均值(正常:≥15次/min,临界:11~14次/min,异常:≤10次/min);(3)卧立位心率变化:测定由卧位转为立位后第30次心搏前后最长R-R间期与第15次心搏前后最短R-R间期的比值(正常:≥1.04,临界:1.01~1.03,异常:≤1.00);(4)卧立位血压差:测定平卧位和站立2 min后的收缩压之差(正常:≤10 mmHg,临界:11~29 mmHg,异常:≥30 mmHg,1 mmHg=0.133kPa)。上述前3项指标反映副交感神经功能,卧立位血压差反映交感神经功能。
CAN诊断标准[6]:(1)正常:所有测试正常或有1项临界值;(2)早期病变:1项心率测试异常或有2项临界值;(3)确诊病变:至少2项心率测试异常;(4)严重病变:至少2项心率测试异常,血压测试异常。以达到确诊病变为标准,将患者分为CAN组和非CAN组。
1.5 统计学处理采用SPSS 24.0和MedCalc进行统计学分析与处理。所有资料进行正态性检验,正态分布计量资料以x±s表示,组间比较采用独立样本t检验或方差分析,非正态分布计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验;计数资料以n(%)表示,组间比较用χ2检验。COMPASS-31总得分与CARTs指标的相关性采用Pearson相关分析。采用多因素logistic回归分析筛选CAN发生的危险因素,并建立多指标联合的诊断模型,通过ROC曲线分析COMPASS-31评分及联合模型对CAN的诊断价值。检验水准(α)为0.05。
2 结果 2.1 患者一般资料本研究共纳入105例2型糖尿病患者,男63例,女42例,平均年龄(53±9)岁。其中36例为早期CAN,33例为确诊CAN,8例为严重CAN。以达到确诊病变为标准分组,CAN组41例(39%),非CAN组64例(61%)。结果(表 1)显示:与非CAN组相比,CAN组患者的年龄更大、糖尿病病程更长、静息心率更快、UACR更高(P < 0.05)。此外,微血管并发症(DSPN、DN、DR)的发生率较高(P < 0.05)。
| 指标 | 非CAN组(n=64) | CAN组(n=41) | 统计值 | P值 |
| 性别(男/女) | 42/22 | 21/20 | 2.161 | 0.142 |
| 年龄(岁) | 51±9 | 58±9 | -4.055 | <0.001 |
| 糖尿病病程(年) | 5(2, 10) | 15(6, 18) | -4.232 | <0.001 |
| 吸烟史n(%) | 14(21.9) | 10(24.4) | 0.090 | 0.765 |
| 饮酒史n(%) | 19(29.7) | 6(14.6) | 3.122 | 0.077 |
| 高血压史n(%) | 31(48.4) | 17(41.5) | 0.490 | 0.484 |
| 糖尿病家族史n(%) | 30(46.9) | 19(46.3) | 0.003 | 0.957 |
| 体质指数(kg/m2) | 24.8±2.7 | 24.8±3.1 | 0.024 | 0.981 |
| 腰臀比 | 0.95±0.06 | 0.95±0.06 | -0.444 | 0.658 |
| 静息心率(次/分) | 72±9 | 76±11 | -2.139 | 0.035 |
| 收缩压(mmHg) | 126±15 | 129±15 | -0.833 | 0.407 |
| 舒张压(mmHg) | 82±10 | 80±9 | 1.207 | 0.230 |
| 空腹血糖(mmol/L) | 9.8±3.5 | 10.0±2.9 | -0.410 | 0.682 |
| 糖化血红蛋白(%) | 9.5±2.9 | 9.8±2.4 | -0.588 | 0.558 |
| 胆固醇(mmol/L) | 4.94±1.22 | 4.76±1.15 | 0.765 | 0.446 |
| 三酰甘油(mmol/L) | 2.46±1.74 | 2.11±1.84 | -0.982 | 0.328 |
| LDL-c(mmol/L) | 2.98±0.92 | 2.74±1.02 | 1.250 | 0.214 |
| HDL-c(mmol/L) | 1.25±0.30 | 1.28±0.35 | -0.378 | 0.706 |
| UACR(mg/g) | 14.1(7.0, 54.7) | 44.5(12.1, 134.8) | -2.801 | 0.005 |
| DSPN n(%) | 36(56.3) | 33(80.5) | 6.516 | 0.011 |
| DN n(%) | 20(31.3) | 24(58.5) | 7.643 | 0.006 |
| DR n(%) | 13(20.3) | 22(53.7) | 12.505 | <0.001 |
| LDL-c:低密度脂蛋白胆固醇;HDL-c:高密度脂蛋白胆固醇;UACR:尿白蛋白/肌酐比值;DSPN:远端对称性多发性神经病变;DN:糖尿病肾病;DR:糖尿病视网膜病变 | ||||
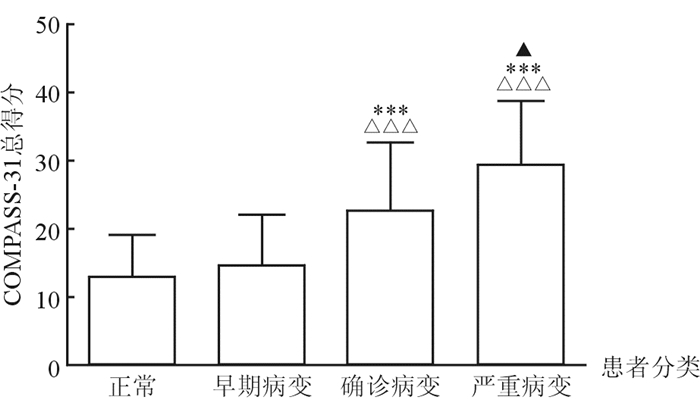
与非CAN组相比,CAN组患者COMPASS-31总得分显著升高(P < 0.001)。除分泌功能领域得分外,CAN组其余5个领域得分均较非CAN组升高(P < 0.05)。此外,CAN不同病变程度患者的COMPASS-31总得分具有显著差异(正常,13.0±6.2;早期病变,14.6±7.5;确诊病变,22.7±10.0;严重病变,29.3±9.4;P < 0.001),见表 2、图 1。
| COMPASS-31得分 | 非CAN组(n=64) | CAN组(n=41) | t/Z值 | P值 |
| 直立不耐受 | 0 | 8.0(0, 14.0) | -3.721 | <0.001 |
| 血管舒缩功能 | 0 | 0(0, 1.7) | -2.315 | 0.021 |
| 分泌功能 | 6.4(2.1, 8.6) | 8.6(4.3, 9.7) | -1.964 | 0.05 |
| 胃肠道功能 | 2.7(1.1, 4.5) | 4.5(3.2, 7.1) | -3.390 | 0.001 |
| 膀胱功能 | 1.1(0.0, 2.2) | 2.2(1.1, 3.3) | -3.693 | <0.001 |
| 瞳孔运动功能 | 1.3(0.4, 1.7) | 1.7(1.0, 2.3) | -2.236 | 0.025 |
| 总分 | 13.9±7.0 | 24.0±10.0 | -4.973 | <0.001 |
|
| 图 1 CAN不同病变程度患者COMPASS-31总得分比较 ***P < 0.001与正常相比;△△△P < 0.001与早期相比; ▲P < 0.05与确诊相比 |
COMPASS-31总得分与深呼吸心率差、瓦氏动作指数、卧立位心率变化均负相关(r为-0.208~-0.368,P < 0.05)。COMPASS-31总得分与卧立位血压差正相关(r=0.268,P < 0.05),见表 3。
| CARTs指标 | COMPASS-31总得分 | |
| r值 | P值 | |
| 深呼吸心率差 | -0.357 | <0.001 |
| 瓦氏动作指数 | -0.368 | <0.001 |
| 卧立位心率变化 | -0.208 | 0.034 |
| 卧立位血压差 | 0.268 | 0.027 |
将表 1中经单因素分析有意义的指标:年龄、糖尿病病程、静息心率、UACR、DSPN、DN、DR、COMPASS-31总得分作为自变量,以CAN是否发生为因变量,进行多因素logistics回归分析,结果显示:年龄、糖尿病病程、静息心率、COMPASS-31总得分仍与CAN风险独立相关(P < 0.05),而其他指标与CAN的发生不再相关。
| 指标 | P | OR | 95%CI | |
| 上限 | 下限 | |||
| 年龄(岁) | 0.020 | 1.101 | 1.015 | 1.193 |
| 糖尿病病程(年) | 0.010 | 1.169 | 1.039 | 1.315 |
| 静息心率(次/min) | 0.009 | 1.093 | 1.022 | 1.168 |
| COMPASS-31总得分(分) | 0.001 | 1.169 | 1.072 | 1.274 |
以CARTs为诊断金标准,运用ROC曲线比较COMPASS-31总得分与一般危险因素对CAN的诊断价值,图 2显示:COMPASS-31总得分的AUC值最大,为0.788(95%CI 0.698~0.862),最佳诊断切点为19.5分,敏感度为68.3%,特异度为79.7%。进一步比较一般危险因素联合及其与COMPASS-31结合的诊断模型,年龄、糖尿病病程、静息心率联合的模型(模型1)诊断CAN的AUC值为0.845(95%CI 0.761~0.908),在模型1基础上引入COMPASS-31总得分后(模型2),AUC值增加至0.905(95%CI 0.832~0.953),差异有统计学意义(P=0.036)。

|
| 图 2 ROC曲线比较不同危险因素及不同模型诊断CAN的价值 A:单个危险因素诊断CAN的价值;B:不同模型诊断CAN的价值,模型1:包括年龄、病程、静息心率,模型2:模型1加COMPASS-31总得分 |
CAN是糖尿病患者发生心律失常、无痛性心肌缺血等心血管事件的独立危险因素[9-10],与心血管死亡风险增加密切相关。多伦多糖尿病神经病变专家小组建议初诊的无症状2型糖尿病患者应进行CAN筛查,尤其是存在大血管或微血管并发症者[6]。由于诊断方法、研究人群等因素影响,2型糖尿病CAN患病率为15.5%~73%[11-13]。本研究中2型糖尿病患者的CAN患病率高达39%,故应引起临床足够的重视。目前,在CAN的众多诊断方法中,CARTs是较为公认的诊断“金标准”,但由于其操作较为复杂,临床上难以作为常规检查项目。因此实际工作中需要简便有效的评估方法来协助诊断CAN。
自主神经包括交感神经和副交感神经,二者主要支配和调节心血管系统、汗腺分泌、消化系统、泌尿系统、呼吸系统和瞳孔等的活动,其功能损害可累及一个或多个系统[14]。COMPASS-31评分是由Slette等[5]提出的一个基于问卷的自主神经症状评估量表,涵盖多系统自主神经症状,目前已用于评估系统性硬化症及肌痛患者的自主神经功能障碍[15-16],在小纤维神经病变中也表现出良好的诊断效能[3]。Greco等[17]以73例1型和2型糖尿病患者为研究对象,发现合并CAN的患者COMPASS-31评分明显高于无CAN者,提示COMPASS-31评分对于CAN的诊断可能具有重要价值。
本研究结果显示,CAN患者的COMPASS-31得分明显高于非CAN患者,包括总得分和子领域得分,主要表现在直立不耐受、膀胱功能和胃肠道功能领域方面。已有相关研究[18-19]表明CAN与胃排空延迟和膀胱功能障碍密切相关。由于CAN发病相对隐匿,因此对于存在其他系统自主神经病变症状的患者要警惕CAN的发生。此外,本研究发现COMPASS-31总得分随着CAN严重程度的增加而升高,说明该评分也可能有助于判断CAN的严重程度。在与CARTs的相关性分析中发现,COMPASS-31得分与CARTs指标相关性良好。因此,COMPASS-31评分可能是一种有效的CAN评估工具。
CAN的危险因素包括年龄、糖尿病病程、血糖控制欠佳以及存在糖尿病微血管并发症[20]。Tang等[21]发现静息心率与CAN独立相关,随着静息心率的增加,CAN患病率上升。本研究结果显示,经过多因素分析后,年龄较大、病程较长、静息心率较快是CAN发生的独立危险因素,与上述研究相符。同时,本研究发现COMPASS-31总得分升高也是CAN的独立危险因素。DSPN和CAN均属于糖尿病周围神经病变,二者的相关性尚有争议[22-23],CAN可先于DSPN发生[24]。本研究中经过多因素分析后DSPN不再与CAN独立相关,提示可能由于二者神经纤维构成不同导致发病机制不完全相同。
本研究采用ROC曲线评价COMPASS-31总得分与3个一般危险因素对CAN的诊断价值,结果显示COMPASS-31总得分的诊断效能最高,诊断切点为>19.5分(敏感度68.3%,特异度79.7%),高于Greco等[17]得出的诊断切点>17分(敏感度70%,特异度66.7%)。本研究纳入对象为住院2型糖尿病患者,因此得到的诊断切点高于Greco等的研究,但可能由于样本量不同、人种差异等因素,导致结果有所差异。为了进一步验证COMPASS-31总得分对CAN的诊断价值,将其纳入包含一般危险因素的模型后,诊断效能可明显提高。
本研究尚存在一些不足:横断面研究,样本量较小,纳入范围较局限,研究对象均为住院患者,病情相对较重。今后将开展多中心、大样本的纵向研究来进一步充实和证实COMPASS-31评分对CAN的诊断价值。
综上所述,本研究发现COMPASS-31评分与经典的CARTs相关性良好,对2型糖尿病CAN具有一定的诊断价值,联合年龄、糖尿病病程、静息心率后可提高诊断效能。COMPASS-31评分简便、快速、临床操作性强,可作为一种CAN评估工具。
| [1] |
POP-BUSUI R, EVANS G W, GERSTEIN H C, et al. Effects of cardiac autonomic dysfunction on mortality risk in the Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial[J]. Diabetes Care, 2010, 33(7): 1578-1584.
[DOI]
|
| [2] |
GAEDE P, VEDEL P, LARSEN N, et al. Multifactorial intervention and cardiovascular disease in patients with type 2 diabetes[J]. N Engl J Med, 2003, 348(5): 383-393.
[DOI]
|
| [3] |
TREISTER R, O'NEIL K, DOWNS H M, et al. Validation of the composite autonomic symptom scale 31(COMPASS-31) in patients with and without small fiber polyneuropathy[J]. Eur J Neurol, 2015, 22(7): 1124-1130.
[DOI]
|
| [4] |
ALBERTI K G, ZIMMET P Z. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1:diagnosis and classification of diabetes mellitus provisional report of a WHO consultation[J]. Diabet Med, 1998, 15(7): 539-553.
[DOI]
|
| [5] |
SLETTEN D M, SUAREZ G A, LOW P A, et al. COMPASS 31:a refined and abbreviated Composite Autonomic Symptom Score[J]. Mayo Clin Proc, 2012, 87(12): 1196-1201.
[DOI]
|
| [6] |
SPALLONE V, ZIEGLER D, FREEMAN R, et al. Cardiovascular autonomic neuropathy in diabetes:clinical impact, assessment, diagnosis, and management[J]. Diabetes Metab Res Rev, 2011, 27(7): 639-653.
[DOI]
|
| [7] |
EWING D J, MARTYN C N, YOUNG R J, et al. The value of cardiovascular autonomic function tests:10 years experience in diabetes[J]. Diabetes Care, 1985, 8(5): 491-498.
[DOI]
|
| [8] |
SPALLONE V, BELLAVERE F, SCIONTI L, et al. Recommendations for the use of cardiovascular tests in diagnosing diabetic autonomic neuropathy[J]. Nutr Metab Cardiovasc Dis, 2011, 21(1): 69-78.
[URI]
|
| [9] |
YOUNG L H, WACKERS F J, CHYUN D A, et al. Cardiac outcomes after screening for asymptomatic coronary artery disease in patients with type 2 diabetes:the DIAD study:a randomized controlled trial[J]. J Am Med Assoc, 2009, 301(15): 1547-1555.
[DOI]
|
| [10] |
POP-BUSUI R, EVANS G W, GERSTEIN H C, et al. Effects of cardiac autonomic dysfunction on mortality risk in the Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial[J]. Diabetes Care, 2010, 33(7): 1578-1584.
[DOI]
|
| [11] |
YUN J S, KIM J H, SONG K H, et al. Cardiovascular autonomic dysfunction predicts severe hypoglycemia in patients with type 2 diabetes:a 10-year follow-up study[J]. Diabetes Care, 2014, 37(1): 235-241.
[DOI]
|
| [12] |
TAHRANI A A, DUBB K, RAYMOND N T, et al. Cardiac autonomic neuropathy predicts renal function decline in patients with type 2 diabetes:a cohort study[J]. Diabetologia, 2014, 57(6): 1249-1256.
[DOI]
|
| [13] |
LOW P A, BENRUD-LARSON L M, SLETTEN D M, et al. Autonomic symptoms and diabetic neuropathy:a population-based study[J]. Diabetes Care, 2004, 27(12): 2942-2947.
[DOI]
|
| [14] |
VINIK A I, MASER R E, MITCHELL B D, et al. Diabetic autonomic neuropathy[J]. Diabetes Care, 2003, 26(5): 1553-1579.
[DOI]
|
| [15] |
ADLER B L, RUSSELL J W, HUMMERS L K, et al. Symptoms of autonomic dysfunction in systemic sclerosis assessed by the COMPASS-31 questionnaire[J]. J Rheumatol, 2018, 45(8): 1145-1152.
[DOI]
|
| [16] |
KANG J H, KIM J K, HONG S H, et al. Heart rate variability for quantification of autonomic dysfunction in fibromyalgia[J]. Ann Rehabil Med, 2016, 40(2): 301-309.
[DOI]
|
| [17] |
GRECO C, DI G F, D'AMATO C, et al. Validation of the Composite Autonomic Symptom Score 31(COMPASS 31) for the assessment of symptoms of autonomic neuropathy in people with diabetes[J]. Diabet Med, 2017, 34(6): 834-838.
[DOI]
|
| [18] |
STACHER G, LENGLINGER J, BERGMANN H, et al. Impaired gastric emptying and altered intragastric meal distribution in diabetes mellitus related to autonomic neuropathy?[J]. Dig Dis Sci, 2003, 48(6): 1027-1034.
[DOI]
|
| [19] |
POP-BUSUI R, HOTALING J, BRAFFETT B H, et al. Cardiovascular autonomic neuropathy, erectile dysfunction and lower urinary tract symptoms in men with type 1 diabetes:findings from the DCCT/EDIC[J]. J Urol, 2015, 193(6): 2045-2051.
[DOI]
|
| [20] |
SPALLONE V. Update on the impact, diagnosis and management of cardiovascular autonomic neuropathy in diabetes:what is defined, what is new, and what is unmet[J]. Diabetes Metab J, 2019, 43(1): 3-30.
[URI]
|
| [21] |
TANG Z H, ZENG F, LI Z, et al. Association and predictive value analysis for resting heart rate and diabetes mellitus on cardiovascular autonomic neuropathy in general population[J]. J Diabetes Res, 2014, 2014(3): 215473.
[URI]
|
| [22] |
VOULGARI C, PSALLAS M, KOKKINOS A, et al. The association between cardiac autonomic neuropathy with metabolic and other factors in subjects with type 1 and type 2 diabetes[J]. J Diabetes Complications, 2011, 25(3): 159-167.
[DOI]
|
| [23] |
PAFILI K, TRYPSIANIS G, PAPAZOGLOU D, et al. Cardiovascular autonomic neuropathy and distal symmetric sensorimotor polyneuropathy:these two diabetic microvascular complications do not invariably co-exist[J]. Curr Vasc Pharmacol, 2018, 16(1).
[URI]
|
| [24] |
OZER F, SARICI K, YAYLA V, et al. Autonomic dysfunction in diabetes mellitus[J]. Endocrinologist, 2006, 16(2): 66-68.
[URI]
|
 2020, Vol. 27
2020, Vol. 27


