亚甲基四氢叶酸还原酶(5, 10-methylenetetra-hydrofolate reductase, MTHFR)是叶酸和同型半胱氨酸代谢的关键酶,催化5, 10-亚甲基四氢叶酸(5, 10-Methylenetetrahydrofolate,5, 10-MTHF)转化为5-甲基四氢叶酸(5-Methyltetrahydrofolate,5-MTHF)。该过程是叶酸的主要循环形式[1]。1972年,Mudd等[2]首次发现了MTHFR与高胱氨酸尿症之间的关系。MTHFR表达异常或活性受损会影响同型半胱氨酸转化为蛋氨酸的能力,使血浆中同型半胱氨酸水平显著增加,同时伴有尿液中同型半胱氨酸增加。后续研究证明,功能性MTHFR基因SNP改变和多种疾病相关,例如会导致动脉粥样硬化和血栓栓塞事件发生,引发心血管疾病[3]、慢性疾病、癌症和药物相关不良反应[1]。
本文基于MTHFR基因结构和功能,评价其对同型半胱氨酸途径的影响,以及基因SNP对疾病和相关药物药代动力学或药效学特性的影响。
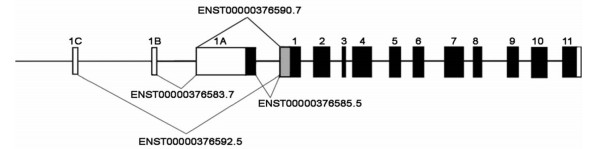
1 MTHFR基因1998年,Goyette等[4]首次报道了MTHFR基因。该基因位于1号染色体上(1p36.3),含有11个外显子[5]。如图 1所示,人MTHFR基因的5′区域包含CAAT和GC盒的共有启动子区域,以及其他几种已知的启动子元件(SP1、AP1、AP2),但是缺乏TATA盒,这种模式多见于参与同型半胱氨酸代谢的基因。有研究[1]报道,参与同型半胱氨酸-蛋氨酸途径的基因多态性和高同型半胱氨酸血症发生相关,而后者是一种多因素疾病。MTHFR基因报道较多的SNP包括MTHFR 677 C>T、MTHFR 1298 A>C、MTHFR1317 T>C和MTHFR 1793 G>A[6]。
|
| 图 1 MTHFR基因结构 黑色矩形:编码开放阅读框(open reading frame, ORF)的外显子;空心矩形:编码非翻译区域(untranslated regions,UTR)的外显子;交叉阴影矩形:编码区域 |
其中,MTHFR 677C>T(rs1801133)位于叶酸结合位点,将丙氨酸变为缬氨酸残基(p.A222V)。MTHFR 1298A>C(rs1801131)位于调节结构域内,将谷氨酸变为丙氨酸残基(p.E429A),而MTHFR 1317T>C是沉默突变。MTHFR 1793G>A引起氨基酸取代(p.R594Q),但可能不影响酶的功能活性[7]。
目前在已知的MTHFR基因SNP中,通常认为677C>T和1298A>C改变会影响酶的活性和功能,因此一般检测这2个位点。SNP的检测方法较多,除了经典的Sanger测序法外,还有限制性片段长度多态性(restriction fragment length polymorphism, RFLP)、微阵列技术(microarray)和聚合酶链式反应(real time polymerase chain reaction,RT-PCR)技术等,可以用于对整个基因或其特定片段进行直接测序[8]。
体外实验对MTHFR表达和酶活性的研究[9]表明,MTHFR 1298CC和677TT纯合突变分别会引起活性降低45%和68%,而同时发生2个SNP突变酶的活性仅保留42%。在红细胞的叶酸代谢途径研究中,MTHFR 677CC个体的叶酸完全经由5-MTHF代谢,而MTHFR 677TT基因型携带者则会出现甲酰化叶酸,提示叶酸循环途径受阻[10]。基于重组MTHFR的功能分析表明,MTHFR 677TT基因型会引起酶活性降低[11]。
677C>T是MTHFR最常见的错义变异,全球突变频率约为40%,该频率随种族不同而异[12]。例如,TT纯合子基因型在非洲国家人中约为1.45%,在土耳其人中为9.6%,在印度人中为12%,在意大利人中为23%,在中国人群中约为10%[12-13]。
2 MTHFR基因SNP对同型半胱氨酸代谢的影响同型半胱氨酸是一种不参与蛋白质合成的氨基酸,是甲硫氨酸代谢的中间体。血浆同型半胱氨酸水平由多个因素决定,例如蛋氨酸代谢酶的遗传改变,维生素B12、维生素B6、叶酸缺乏等[14-15]。叶酸前体在通过MTHFR转化为叶酸之前不具有生物活性。叶酸是细胞生成四氢叶酸(tetrahydrofolic acid,THF)的底物,后者是正常蛋氨酸合成所必需的5-MTHF的前体合酶,是叶酸的天然循环形式。叶酸通过增加S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)将一碳单位转移至各种有机化合物。有2种途径可以降低高半胱氨酸:口服高剂量叶酸或5-MTHF[16]。除叶酸外,维生素B6和维生素B12也是同型半胱氨酸代谢中必需的辅助因子[17]。
3 MTHFR可导致多系统疾病MTHFR参与调节5-MTHF对同型半胱氨酸重甲基化,但MTHFR基因SNP改变引起的生理效应不能仅归因于同型半胱氨酸水平的增加[18]。目前,相关生理效应是由于同型半胱氨酸水平升高还是叶酸缺乏或两者兼而有之,仍是争论的焦点。高同型半胱氨酸血症人群中,通常伴有多种病理状况的风险增加有关,包括心脑血管疾病、神经退行性疾病、自身免疫疾病、先天缺陷、糖尿病、神经系统疾病、癌症和肾病[1]。本文重点关注677C>T和1298A>C对不同系统疾病的影响。
3.1 心脑血管疾病基于高同型半胱氨酸血症是动脉粥样硬化的重要危险因素,MTHFR基因的遗传变异被广泛用于心血管疾病的遗传分析研究[1]。此外,内皮细胞只能通过叶酸和维生素B12依赖的再甲基化途径清除同型半胱氨酸,这种途径受MTHFR和蛋氨酸合成酶共同调节。因此,两种酶的正常活性对于防止血管内皮细胞中同型半胱氨酸病理性增加至关重要[19]。已有研究关注MTHFR 677C>T和1298A>C与心肌梗死(myocardial infarction,MI)易感性的关系,尽管不同人群中的数据并不一致,但仍有趋势表明MTHFR基因SNP和心血管疾病发生风险增加有关[20-22]。一项荟萃分析纳入MEDLINE和EMBASE数据库中的47项研究,分析677C>T和1298A>C对MI风险的可能影响。在总体患者人群中,MTHFR 1298A>C基因型与MI风险之间缺乏显著相关性。相反,在通过种族进行的亚组分析中,携带MTHFR 677C>T中T等位基因的非洲国家人群发生MI风险增加63%;而在美国人群中,杂合子CT基因型与CC基因型相比,使其MI风险降低19%。在欧洲和亚洲人群的数据分析中没有发现类似的关联。同样,按年龄分组后,MTHFR 677C>T和50岁人群MI风险增加有关,可作为疾病预防策略[23]。
中风是全球第2大死亡原因,也是一个重大的公共卫生问题[24]。全球中风的发病率为每年(400~800)/100 000[24]。遗传因素、环境因素都和中风发生相关。有研究[14, 25]表明,MTHFR 677C>T多态性是不同种族卒中发生的潜在危险因素。Vijayan等[10]在南印度人群中评估多态性MTHFR 677C>T对缺血性卒中风险的影响,发现在缺血性卒中患者中MTHFR 677C>T的T等位基因频率高于健康对照组。同样的,Cronin等[26]的荟萃分析报道,MTHFR 677TT基因型与北欧和中欧人群的缺血性卒中风险无统计学相关性,但与意大利和日本人群有显著相关性。这种差异与剂量依赖性效应和叶酸状态在人群间的差异有关。一项关于遗传研究和临床试验的大型荟萃[27]分析表明,MTHFR 677C>T基因变异对卒中风险的影响可以通过叶酸状态来改变。因此,应根据叶酸基线水平和MTHFR基因677C>T的综合影响来评估叶酸在卒中预防中的功效。
MTHFR基因型对卒中风险的影响受到人群膳食中叶酸水平的影响。中国卒中一级预防试验(China stroke primary prevention trial,CSPPT)是一项大型随机试验,研究中国成人高血压患者(无中风或心肌梗死史)补充叶酸和降低其脑卒中发生风险之间的关系。研究采用MTHFR基因型和个体基线叶酸值评价叶酸干预疗法的效果,发现血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制剂联合叶酸治疗与单用ACE抑制剂相比,可降低首次卒中的相对风险约21%[28]。进一步调整重要协变量后,发现基线同型半胱氨酸水平与卒中发生风险无关。在大多数没有强制性叶酸食品补充的国家,叶酸摄入不足是普遍现象。在携带CC或CT基因型的个体中,卒中发生的风险和叶酸治疗的最大益处取决于最低基线叶酸水平。此外,携带TT基因型的个体可能需要更高剂量的叶酸补充剂。结果表明,在强制性补充叶酸的国家,叶酸治疗可进一步降低卒中发病风险,即使在TT基因型携带者或低~中等基线叶酸水平者中也有作用[29]。
3.2 神经退行性疾病循环中低叶酸水平和高同型半胱氨酸浓度与人群认知表现有关[1]。同型半胱氨酸水平升高会引起神经毒性和血管毒性。有学者认为同型半胱氨酸是早期认知衰退的直接标志物[27]。有证据表明同型半胱氨酸水平的变化可能对多巴胺能神经元具有毒性。一项评估MTHFR 677C>T和MTHFR 1298A>C对帕金森病影响的对照研究[30]表明,MTHFR 677C>T的T等位基因和MTHFR 1298A>C的AA基因型对疾病发生具有保护作用。
3.3 自身免疫性疾病自身免疫疾病是一种慢性炎症性疾病,可导致过早死亡、高发病率和严重功能障碍,给患者和社会造成极大的经济负担。疾病进展和并发症情况在患者之间差异明显,而遗传因素可能导致其高风险[31]。类风湿性关节炎是一种常见的自身免疫性疾病,全球有0.5%~1%的人群受累[32]。类似的,MTHFR基因SNP对类风湿性关节炎风险的影响存在人群差异。最近一项荟萃分析[32]研究了677C>T和1298A>C对类风湿性关节炎遗传易感性的联合作用,显示亚洲人群中MTHFR 677C>T的T等位基因与整体人群中MTHFR 1298A>C的A等位基因与疾病发生有相关性。
3.4 出生缺陷类疾病先天性神经管缺陷是新生儿家庭的主要健康负担。全球发病率为(0.5~2)/1 000次怀孕[33]。这类畸形一旦发生会导致新生儿和婴儿死亡或终生残疾。这些畸形源于神经褶皱在中线融合失败,并在胚胎发育的第3周和第4周之间形成神经管。大多数神经管缺陷是散发性的,与遗传或非遗传环境因素有关。遗传易感性是疾病的主要潜在危险因素[34]。有关MTHFR和先天性神经管缺陷之间关系的报道结果并不一致。一些小样本人群研究汇总未发现MTHFR基因的677C>T和1298A>C与神经管缺陷之间存在显著相关性[35]。
口面裂缝是人类最常见的先天缺陷之一,但是在不同地域和种族中的流行率不同;这类疾病具有复杂的多因素遗传,涉及遗传和环境因素等[36]。Wilcox等[37]提出,围孕期使用叶酸可以预防唇裂和腭裂的发生。还有研究[14]报道,携带两种功能性MTHFR多态性杂合子母亲生产腭裂患儿的风险增加。如果携带MTHFR 677TT或MTHFR 1298CC基因型的孕妇膳食中叶酸或叶酸补充剂的摄入量较低,则出现腭裂儿童的风险增加,表明这2种MTHFR基因SNP是口面裂隙的独立危险因素。
3.5 糖尿病2型糖尿病是一种多因素相关的疾病,随疾病进展会出现慢性、多器官并发症。MTHFR基因SNP与糖尿病和微/大血管并发症有关[38]。类似的,MTHFR基因型与糖尿病之间的关联存在明显的种族差异。El Hajj Chehadeh在一项阿联酋人群的研究[39]中发现,糖尿病患者和健康对照者的基因型和单倍型分布没有显著差异。我国的一项荟萃分析[40]侧重于MTHFR 1298A>C基因型与糖尿病易感性之间的关系,证实了其与种族相关的差异。通过对PubMed、Embase、CBM、CNKI等数据库中相关文献的系统评价,MTHFR 1298A>C SNP显著影响亚洲人的糖尿病易感性。但在高加索人中没有观察到这种关联。
3.6 癌症叶酸缺乏被认为可以破坏DNA修复受损和DNA甲基化引起原癌基因激活而增加癌症发生的风险[41]。肿瘤的发生是一个复杂的过程,基因多态性或是基因-环境的相互作用与其进展相关。2007年的一项荟萃分析[42]表明,MTHFR 677C>T对乳腺癌风险有中度影响;另一方面,基于种族的亚组分析显示,携带TT基因型与亚洲人群乳腺癌的发生显著相关,但在高加索人群中无此相关性。MTHFR 677C>T对肾细胞癌的发生也有影响。Lv等[43]发现,即使MTHFR 677C>T基因型与肾细胞癌易感性之间没有关联,但MTHFR 677C>T可能对肾细胞癌的发生有保护作用。而既往研究[44]则表明,MTHFR 677C>T基因型和T等位基因对肾癌风险有显著影响。不同研究之间结果的不一致可能是由于种族和样本量存在差异。
4 药理学遗传变异可以影响几种药物的药代动力学或药效学特性,并且可以解释患者中治疗反应和不良事件的个体间差异等。
4.1 甲氨蝶呤在接受甲氨蝶呤治疗的类风湿性关节炎患者中,MTHFR 677C>T和1298A>C能显著增加甲氨蝶呤治疗效果[45]。MTHFR 677C>T与甲氨蝶呤治疗引起胃肠道毒性风险增加相关,该相关性与甲氨蝶呤剂量无关[46]。MTHFR 1298A>C可能不引起肝脏和血液毒性,而可能对黏膜炎和胃肠道有保护作用。
4.2 5-氟尿嘧啶(5-FU)在接受5-FU方案治疗的实体肿瘤患者中,MTHFR 677C>T和5-FU相关不良反应显著相关,包括脱发、腹泻、呕吐、皮炎和血液系统改变,携带突变基因T的患者更易出现明显的不良反应,但是化疗敏感性也更佳。然而,在多项研究中MTHFR 1298A>C和5-FU相关的不良反应不相关。但是,不同研究之间存在一定差异,这可能与研究人群、样本量差异有关。
5 小结同型半胱氨酸水平和MTHFR基因SNP与多种疾病相关。MTHFR 677C>T与甲氨蝶呤、5-FU治疗不良反应相关,可作为药物相关不良反应的预测因子。同时,MTHFR基因SNP与多系统疾病、多种肿瘤等存在一定关联。神经管缺陷和认知障碍与MTHFR基因SNP之间的关系尚需较大样本量的长期随访研究。此外,运用新型的生物学检测技术、生物信息学工具及功能学研究将有助于揭示MTHFR基因的遗传学效应。
| [1] |
BURDENNYY A M, LOGINOV V I, ZAVARYKINA T M, et al. The role of molecular genetic alterations in genes involved in folate and homocysteine metabolism in multifactorial diseases pathogenesis[J]. Russ J Genet, 2017, 53(5): 528-541.
[DOI]
|
| [2] |
STEED M M, TYAGI S C. Mechanisms of cardiovascular remodeling in hyperhomocysteinemia[J]. Antioxid Redox Signal, 2011, 15(7): 1927-1943.
[DOI]
|
| [3] |
BERWANGER C S, JEREMY J Y, STANSBY G. Homocysteine and vascular disease[J]. Br J Surg, 1995, 82(6): 726-731.
[DOI]
|
| [4] |
OZEN F, SEN M, OZDEMIR O. Methylenetetrahydrofolate reductase gene germ-line C677T and A1298C SNPs are associated with colorectal cancer risk in the Turkish population[J]. Asian Pac J Cancer Prev, 2014, 15(18): 7731-7735.
[DOI]
|
| [5] |
TOSETTO A, MISSIAGLIA E, FREZZATO M, et al. The VITA project:C677T mutation in the methylene-tetrahydrofolate reductase gene and risk of venous thromboembolism[J]. Br J Haematol, 1997, 97(4): 804-806.
[URI]
|
| [6] |
MURTO T, KALLAK T K, HOAS A, et al. Folic acid supplementation and methylenetetrahydrofolate reductase (MTHFR) gene variations in relation to in vitro fertilization pregnancy outcome[J]. Acta Obstet Gynecol Scand, 2015, 94(1): 65-71.
[DOI]
|
| [7] |
LI X, JIANG J, XU M, et al. Individualized supplementation of folic acid according to polymorphisms of methylenetetrahydrofolate reductase (MTHFR), methionine synthase reductase (MTRR) reduced pregnant complications[J]. Gynecol Obstet Invest, 2015, 79(2): 107-112.
[DOI]
|
| [8] |
TORTAJADA-GENARO L A, PUCHADES R, MAQUIEIRA Á. Primer design for SNP genotyping based on allele-specific amplification-Application to organ transplantation pharmacogenomics[J]. J Pharm Biomed Anal, 2017, 136: 14-21.
[DOI]
|
| [9] |
SENEMAR S, SAFFARI B, SHARIFKAZEMI M B, et al. 5, 10-methylene tetrahydrofolate reductase C677T gene polymorphism, homocysteine concentration and the extent of premature coronary artery disease in Southern Iran[J]. EXCLI J, 2013, 12: 437-448.
[URI]
|
| [10] |
GŁĄBSKA D, KSIĄŻEK A, GUZEK D. Development and validation of the brief folate-specific food frequency questionnaire for young women's diet assessment[J]. Int J Environ Res Public Health, 2017, 14(12): pii:E1574.
[DOI]
|
| [11] |
YANG Y, LUO Y Y, WU S, et al. Association between C677T and A1298C polymorphisms of the MTHFR gene and risk of male infertility:a meta-analysis[J]. Genet Mol Res, 2016, 15(2).
[URI]
|
| [12] |
BÖTTIGER A K, HURTIG-WENNLÖF A, SJÖSTRÖM M, et al. Association of total plasma homocysteine with methylenetetrahydrofolate reductase genotypes 677C>T, 1298A>C, and 1793G>A and the corresponding haplotypes in Swedish children and adolescents[J]. Int J Mol Med, 2007, 19(4): 659-665.
[URI]
|
| [13] |
YUN L, XU R, LI G, et al. Homocysteine and the C677T gene polymorphism of its key metabolic enzyme mthfr are risk factors of early renal damage in hypertension in a Chinese Han population[J]. Medicine (Baltimore), 2015, 94(52): e2389.
[DOI]
|
| [14] |
VIJAYAN M, CHINNIAH R, RAVI P M, et al. MTHFR (C677T) CT genotype and CT-apoE3/3 genotypic combination predisposes the risk of ischemic stroke[J]. Gene, 2016, 591(2): 465-470.
[DOI]
|
| [15] |
CIANCIOLO G, LA MANNA G, COLÌ L, et al. 5-methyltetrahydrofolate administration is associated with prolonged survival and reduced inflammation in ESRD patients[J]. Am J Nephrol, 2008, 28(6): 941-948.
[URI]
|
| [16] |
NI J, LIU Y, ZHOU T, et al. Single nucleotide polymorphisms in key one-carbon metabolism genes and their association with blood folate and homocysteine levels in a Chinese population in Yunnan[J]. Genet Test Mol Biomarkers, 2018, 22(3): 193-198.
[DOI]
|
| [17] |
DEBRECENI B, DEBRECENI L. The role of homocysteine-lowering B-vitamins in the primary prevention of cardiovascular disease[J]. Cardiovasc Ther, 2014, 32(3): 130-138.
[DOI]
|
| [18] |
KAŁUŻNA-CZAPLIŃSKA J, ŻURAWICZ E, MICHALSKA M, et al. A focus on homocysteine in autism[J]. Acta Biochim Pol, 2013, 60(2): 137-142.
[URI]
|
| [19] |
ANGELINE T, JEYARAJ N, TSONGALIS G J. MTHFR Gene polymorphisms, B-vitamins and hyperhomocystinemia in young and middle-aged acute myocardial infarction patients[J]. Exp Mol Pathol, 2007, 82(3): 227-233.
[URI]
|
| [20] |
ZEE R Y, MORA S, CHENG S, et al. Homocysteine, 5, 10-methylenetetrahydrofolate reductase 677C>T polymorphism, nutrient intake, and incident cardiovascular disease in 24, 968 initially healthy women[J]. Clin Chem, 2007, 53(5): 845-851.
[DOI]
|
| [21] |
ALIZADEH S, DJAFARIAN K, MORADI S, et al. C667T and A1298C polymorphisms of methylenetetrahydrofolate reductase gene and susceptibility to myocardial infarction:A systematic review and meta-analysis[J]. Int J Cardiol, 2016, 217: 99-108.
[DOI]
|
| [22] |
WU Y L, HU C Y, LU S S, et al. Association between methylenetetrahydrofolate reductase (MTHFR) C677T/A1298C polymorphisms and essential hypertension:A systematic review and meta-analysis[J]. Metabolism, 2014, 63(12): 1503-1511.
[DOI]
|
| [23] |
ZHU X Y, HOU R Y, PAN X D, et al. Association between the methylenetetrahydrofolate reductase (MTHFR) gene C677T polymorphism and ischemic stroke in the Chinese population:a meta-analysis[J]. Int J Neurosci, 2015, 125(12): 885-894.
[DOI]
|
| [24] |
WHO. The atlas of heart disease and stroke[EB/OL].[2011-10-19]. http://www.who.int/cardiovascular_diseases/resources/atlas/en/. [URI]
|
| [25] |
HOLMES M V, NEWCOMBE P, HUBACEK J A, et al. Effect modification by population dietary folate on the association between MTHFR genotype, homocysteine, and stroke risk:a meta-analysis of genetic studies and randomised trials[J]. Lancet, 2011, 378(9791): 584-594.
[DOI]
|
| [26] |
HUO Y, LI J, QIN X, et al. Efficacy of folic acid therapy in primary prevention of stroke among adults with hypertension in China:the CSPPT randomized clinical trial[J]. JAMA, 2015, 313(13): 1325-1335.
[DOI]
|
| [27] |
FEI M, TIANFENG W, JIANGANG Z, et al. Plasma homocysteine and serum folate and vitamin B12 levels in mild cognitive impairment and alzheimer's disease:a case-control study[J]. Nutrients, 2017, 9(7): pii:E725.
[DOI]
|
| [28] |
XU X, QIN X, LI Y, et al. Efficacy of folic acid therapy on the progression of chronic kidney disease:the renal substudy of the china stroke primary prevention trial[J]. JAMA Intern Med, 2016, 176(10): 1443-1450.
[DOI]
|
| [29] |
YUAN L, SONG Z, DENG X, et al. Association of the MTHFR rs1801131 and rs1801133 variants in sporadic Parkinson's disease patients[J]. Neurosci Lett, 2016, 616: 26-31.
[DOI]
|
| [30] |
RAVAGLIA G, FORTI P, MAIOLI F, et al. Common polymorphisms in methylenetetrahydrofolate reductase(MTHFR):relationships with plasma homocysteine concentrations and cognitive status in elderly northern italian subjects[J]. Arch Gerontol Geriatr Suppl, 2004, Suppl 9: 339-348.
[URI]
|
| [31] |
RODRIGUEZ-RODRIGUEZ L, LÓPEZ-MEJIAS R, FERNÁNDEZ-GUTIÉRREZ B, et al. Rheumatoid arthritis:genetic variants as biomarkers of cardiovascular disease[J]. Curr Pharm Des, 2015, 21(2): 182-201.
[URI]
|
| [32] |
CEN H, HUANG H, ZHANG L N, et al. Associations of methylenetetrahydrofolate reductase (MTHFR) C677T and A1298C polymorphisms with genetic susceptibility to rheumatoid arthritis:a meta-analysis[J]. Clin Rheumatol, 2017, 36(2): 287-297.
[DOI]
|
| [33] |
SALIH M A, MURSHID W R, SEIDAHMED M Z. Classification, clinical features, and genetics of neural tube defects[J]. Saudi Med J, 2014, 35(Suppl 1): S5-S14.
[URI]
|
| [34] |
FANG Y, ZHANG R, ZHI X, et al. Association of main folate metabolic pathway gene polymorphisms with neural tube defects in Han population of Northern China[J]. Childs Nerv Syst, 2018, 34(4): 725-729.
[DOI]
|
| [35] |
GILDESTAD T, BJØRGE T, VOLLSET S E, et al. Folic acid supplements and risk for oral clefts in the newborn:a population-based study[J]. Br J Nutr, 2015, 114(9): 1456-1463.
[DOI]
|
| [36] |
DE AGUIAR P K, COLETTA R D, DE OLIVEIRA A M, et al. rs1801133C>T polymorphism in MTHFR is a risk factor for nonsyndromic cleft lip with or without cleft palate in the Brazilian population[J]. Birth Defects Res A Clin Mol Teratol, 2015, 103(4): 292-298.
[DOI]
|
| [37] |
WILCOX A J, LIE R T, SOLVOLL K, et al. Folic acidsupplements and risk of facial clefts: national population based case-control study[J]. BMJ, 2007, 3;334(7591): 464. [URI]
|
| [38] |
ZHOU T B, DRUMMEN G P, JIANG Z P, et al. Methylenetetrahydrofolate reductase (MTHFR) C677T gene polymorphism and diabetic nephropathy susceptibility in patients with type 2 diabetes mellitus[J]. Ren Fail, 2015, 37(8): 1247-1259.
[DOI]
|
| [39] |
EL HAJJ CHEHADEH S W, JELINEK H F, AL MAHMEED W A, et al. Relationship between MTHFR C677T and A1298C gene polymorphisms and complications of type 2 diabetes mellitus in an Emirati population[J]. Meta Gene, 2016, 9: 70-75.
[DOI]
|
| [40] |
YAN Y, LIANG H, YANG S, et al. Methylenetetrahydrofolate reductase A1298C polymorphism and diabetes risk:evidence from a meta-analysis[J]. Ren Fail, 2014, 36(7): 1013-1017.
[DOI]
|
| [41] |
WYATT M D, BRADY K, LITVINCHUK A, et al. Chromosomal instability and DNA repair status during folic acid deficiency in breast cancer cells[J]. Cancer Research, 2012, 72(8 Supplement): 2549-2549.
[URI]
|
| [42] |
LIU W, LI Y, LI R, et al. Association of MTHFR A1298c polymorphism with breast cancer and/or ovarian cancer risk:an updated meta-analysis[J]. Afr J Tradit Complement Altern Med, 2016, 13(5): 72-86.
[URI]
|
| [43] |
LV C, BAI Z, LIU Z, et al. Renal cell carcinoma risk is associated with the interactions of APOE, VHL and MTHFR gene polymorphisms[J]. Int J Clin Exp Pathol, 2015, 8(5): 5781-5786.
[URI]
|
| [44] |
MOORE L E, HUNG R, KARAMI S, et al. Folate metabolism genes, vegetable intake and renal cancer risk in central Europe[J]. Int J Cancer, 2008, 122(8): 1710-1715.
[URI]
|
| [45] |
PARK J A, SHIN H Y. Influence of genetic polymorphisms in the folate pathway on toxicity after high-dose methotrexate treatment in pediatric osteosarcoma[J]. Blood Res, 2016, 51(1): 50-57.
[DOI]
|
| [46] |
SPYRIDOPOULOU K P, DIMOU N L, HAMODRAKAS S J, et al. Methylene tetrahydrofolate reductase gene polymorphisms and their association with methotrexate toxicity:a meta-analysis[J]. Pharmacogenet Genomics, 2012, 22(2): 117-133.
[DOI]
|
 2020, Vol. 27
2020, Vol. 27


